传统的药物发现主要集中在蛋白质活性的直接调控上。蛋白质活性调节剂,特别是抑制剂的开发和应用一直是药物开发的主流。近年来,靶向蛋白降解剂(TPD)快速发展,有望彻底变革药物发现和开发。与传统的小分子抑制剂主要通过阻断蛋白质活性的方法不同,TPD采用的是利用细胞内自身的蛋白清除机制来消除目标蛋白质。这种独特的策略为药物发现带来了多方面的优势,例如,TPD可以影响蛋白的非催化功能,并有望克服以前被视为“不可成药”的靶点。在本文中,药明康德内容团队将结合公开资料,深入探讨TPD的工作机理、特性,以及它与传统小分子抑制剂在哪些方面存在差异。
什么是靶向蛋白降解?
靶向蛋白降解是一种新的药物发现方法,可以彻底消除蛋白质,而不仅仅是抑制它们的活性。TPD的工作原理是利用细胞自身的蛋白质清除机制,即蛋白酶体和溶酶体途径,选择性地降解致病蛋白质。
一般来说,蛋白酶体通过泛素-蛋白酶体系统(UPS)来消除目标蛋白质(主要为短半衰期的蛋白),溶酶体则通过内吞作用、吞噬作用或自噬途径来降解半衰期较长的蛋白质、不溶性蛋白聚集体,甚至整个细胞器、大分子化合物和细胞内寄生物。
经蛋白酶体降解途径发挥作用的TPD包括PROTAC、分子胶、以及双机制降解剂,经溶酶体途径发挥作用的TPD主要有LYTAC、GlueTAC、AbTAC、ATTEC、AUTAC、双特异性核酸适配体嵌合体、AUTOTAC、以及基于分子伴侣介导的自噬(CMA)降解剂。
TPD展现出在多个方面的优越性,这包括对“不可成药”蛋白靶点的靶向能力、克服高蛋白水平的影响来发挥作用、对蛋白质的非催化功能产生影响,以及根据E3连接酶的表达情况实现组织选择性等等。总的来说,TPD作为一个新的药物模式,具有巨大的潜力来应对当前的未竟医疗需求。

TPD与传统小分子的十大区别
TPD与传统的小分子抑制方式之间的差异已经得到了理论层面的证明。近年来,临床和体内概念验证研究的推进进一步揭示了这些差异的多个方面。
1. 蛋白降解剂与配体作用方式无关
与传统小分子不同,蛋白降解剂的作用并不依赖于其靶点的特定作用模式(例如激动、部分激动、拮抗等),它们只需要与目标靶点结合即可有效引导目标蛋白发生降解。这一特点规避了在筛选配体时的复杂情况,因为对于某些靶点,传统小分子的作用表现为拮抗剂或是激动剂并非总是可预测的。这种差异化的表现在雄激素受体(AR)降解剂和雌激素受体(ER)降解剂的实例中尤为明显。
AR是前列腺癌治疗的常用靶点,由于肿瘤细胞的AR发生突变导致一些小分子拮抗剂的作用方式由拮抗剂转变为激动剂,从而造成肿瘤生长加速、治疗失败。在这种情况下,如果采用TPD进行治疗,药物分子对于AR的功能效应(激活或抑制)已不再重要,因为目标蛋白会被彻底清除。
例如,Arvinas开发的第二代可口服的AR降解剂ARV-766,与其前身ARV-110相比,它具有更广泛的基因型覆盖率和更好的立体化学稳定性。最新公布的临床试验数据显示,ARV-766使42%带有AR配体结合域(LBD)突变患者的前列腺特异性抗原(PSA)水平降低≥50%(PSA50)。具有AR L702H突变的5名患者中有3名达到了PSA50,这3名缓解的AR L702H患者都有同时出现的T878/H875突变。在带有AR LBD突变肿瘤的4名RECIST可评估患者中,有两名观察到部分缓解(1名确认部分缓解,1名未确认部分缓解)。
类似的情况也发生在乳腺癌治疗中。他莫昔芬主要作为ER拮抗剂发挥作用,但在某些情况下,它可作为ER部分激动剂在长期治疗后导致继发性癌症。对此,针对ER的蛋白降解剂成为了解决方案。比如氟维司群,它既可以拮抗ER功能又能诱导其降解,但其靶点覆盖浓度和药代动力学(PK)属性不佳,因此,研究人员正在开发具有更强ER靶点覆盖能力的口服ER降解剂,这些降解剂不易受到改变靶点作用方式的基因突变的影响。
这类新一代ER降解剂包括Stemline Therapeutics开发的elacestrant、基因泰克旗下的giredestrant(GDC-9545)、赛诺菲的amsenestrant、阿斯利康的AZD9833和Arvinas的ARV-471。其中,elacestrant在今年年初已获得美国FDA的批准上市,用于治疗患有雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)、ESR1突变的晚期或转移性乳腺癌的绝经后妇女或成年男子,这些患者在接受过至少一线内分泌治疗后出现疾病进展。
2. 克服高蛋白质水平
克服由非预期目标激活引起的高蛋白水平是药物开发中所面临的挑战之一。比如E3连接酶MDM2是经典抑癌蛋白p53的负调控因子,可以介导p53的降解。MDM2抑制或降解可以阻断p53的降解,然而,靶向MDM2的关键挑战包括健康组织中p53的伴随激活,以及MDM2水平的上升——通常MDM2小分子抑制剂的使用会导致细胞通过反馈通路,生成更多的MDM2蛋白,导致小分子抑制剂失效。
Kymera Therapeutics的MDM2降解剂KT-253旨在解决这一难点,在临床前实验中,KT-253可以克服这一反馈通路的影响,它能够稳定p53的水平,并且导致癌细胞的死亡。在动物模型中,单剂KT-253治疗可以导致持久的肿瘤消退。
3. 可影响蛋白的非催化功能
传统的小分子抑制剂仅能阻断蛋白质的活性,TPD通过完全消除目标蛋白质,不仅可以阻断蛋白的催化功能,还可以影响其他功能,比如蛋白间相互作用、以及组成大型蛋白复合物的能力等等。
其中一个应用实例是BRAF蛋白靶点。虽然BRAF突变体是经过临床验证的致癌靶点,然而目前已有的BRAF抑制剂反而可能激活野生型RAF,导致疗效降低,并且激发耐药性突变。具体来说,在某些情况下,与抑制剂结合的BRAF突变体蛋白可以充当支架,招募野生型RAF形成信号复合物,增强野生型RAF信号从而导致继发性癌症。
C4 Therapeutics公司开发的创新BRAF降解剂CFT1946可以避免上述情况的发生。CFT1946可以直接降解突变BRAF蛋白,消除其蛋白支架的功能,从而彻底规避RAF信号的异常激活。在临床前研究中,CFT1946导致BRAF-V600E突变体的降解,显著抑制MAPK信号传导,并且在降低BRAF-V600E细胞生存能力的同时并未影响野生型BRAF细胞。在BRAF-V600E小鼠肿瘤模型中,CFT1946也导致肿瘤显著缩小。
这种靶向BRAF突变体的蛋白降解策略有望更为有效地阻断BRAF突变体介导的信号传递,获得更为持久的疗效。
类似的例子还有针对BRD9蛋白和IRAK4蛋白的药物开发,这两种蛋白都因其独特的蛋白支架功能而参与了癌症或免疫相关疾病的病理过程。通过TPD消除其蛋白支架功能,有望为这些疾病提供更多治疗选择。目前,C4 Therapeutics开发的BRD9蛋白降解剂CFT8634的IND申请已获得批准,启动临床试验的招募工作。在滑膜肉瘤的临床前模型中,CFT8634表现出持续降低肿瘤体积的效果。Kymera Therapeutics开发口服IRAK4抑制剂KT-474的早期临床结果积极,显示出对多种疾病相关细胞因子的广泛和深度抑制,显著缓解了特应性皮炎和化脓性汗腺炎的临床症状。
4. 不受限于靶点饱和度
与小分子抑制剂不同,TPD无需通过完全占据靶蛋白形成E3酶-降解剂-靶蛋白复合物来发挥作用,因此,降解物和靶蛋白之间所需的结合亲和力理论上远低于小分子抑制剂所需的亲和力。此外,由于靶蛋白的浓度随着时间的推移而降低,TPD的药效学效应可以随着时间的推移而积累,因此可以在较低剂量的慢性给药中获得更深度的疗效。
例如,Nurix Therapeutics的BTK蛋白降解剂NX-2127,尽管它对于某些BTK突变体的配体亲和力较低,并且生物利用度不佳,但这并不妨碍它的效果。在1期临床试验中,NX-2127不但强力且持久地降解了B细胞血液恶性肿瘤患者体内的BTK,还让多名患者获得有意义的临床益处,在携带BTK耐药性突变的患者中也观察到部分缓解。
此外,还有一些TPD能够在较低的生化亲和力条件下发挥作用,如STAT3降解剂。Kymera Therapeutics旗下STAT3降解剂KT-333已迈入临床研究阶段,最新临床数据显示,KT-333显示出剂量依赖性的STAT3降解,在外周血单核细胞中平均最大降解水平达88%,并有STAT3通路受抑制和外周血中炎症生物标记物下调的迹象。
5. 体内药代动力学/药效学效应延长
GSK开发的一款RIPK2降解剂能够展现出远超基于其PK所预期的长期药效——在给予单剂量RIPK2降解剂治疗后,大鼠体内的RIPK2蛋白被显著降解,并且需要很长时间(240小时)才能恢复到基线水平。这表明此药物可以长时间起作用,在给药后的许多天内也有功能效应。

6. 更广阔的结合位点选择
TPD的核心作用在于破坏蛋白质,因此,与小分子抑制剂不同,它们的配体并不需要对目标蛋白质产生直接的功能效应,例如抑制、激活或构象变化等。只要配体的结合能够引发泛素化途径,它们就足以完成其使命。这一特性增加了蛋白降解剂可选择的结合位点的多样性。
利用蛋白降解剂这一特性的应用实例主要有变构EGFR降解剂。C4 Therapeutics和罗氏利用非功能性结合位点,合作开发了一种新型口服变构EGFR L858R降解剂。在EGFR中,L858R突变产生了一个在野生型EGFR蛋白中不存在的变构结合位点,这为药物分子靶向突变体而不是野生型EGFR蛋白创造了机会,并且不需要依赖活性位点。TPD将EGFR突变体作为降解的目标,并且以50 mpk PO/BID的剂量在啮齿类动物的脑转移模型中显示出活性,尽管其分子体积巨大,但对突变体EGFR的活性和选择性都非常优秀。
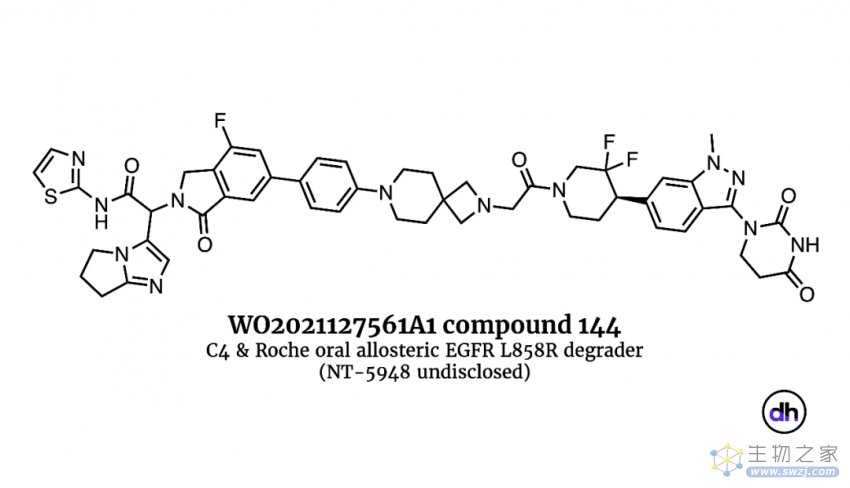
▲C4 Therapeutics和罗氏开发的创新EGFR L858R蛋白降解剂化学分子结构(图片来源:参考资料[1])
7. 基于E3连接酶表达差异的组织选择性
因为TPD所必需的E3连接酶在不同组织间存在表达差异,使得TPD在某些组织中可能更具选择性,这种选择性超出了TPD对其目标蛋白在靶点结合方面的固有选择性。
Dialectic Therapeutics公司的Bcl-XL降解剂DT2216便是基于上述观点而开发产生的。Bcl-XL是一种抗凋亡蛋白,但是针对这个靶标的药物可能会导致血小板水平降低。E3泛素连接酶VHL在血小板中的表达较低,通过使用降解剂募集VHL连接酶,可以靶向特定的肿瘤类型,而不会出现血小板减少的副作用。虽然VHL的表达水平和DT2216对于血小板再生的影响尚未被充分了解,但在临床前研究中,DT2216作为单药或联合化疗在各种血液学和实体瘤中产生抗癌活性。目前该分子正处于1期临床开发阶段。
8. 基于形成蛋白复合物的能力而表现出靶点选择性
在针对黑色素瘤的治疗中,突变型BRAF抑制剂发挥着重要作用,但是突变型和野生型BRAF蛋白间的结构差异往往非常微小,这可能导致针对野生型BRAF的非预期抑制效应(脱靶效应)。BRAF蛋白降解剂CFT1946对于突变型BRAF蛋白的选择性远高于野生型BRAF,在实验中甚至未在细胞内检测到对野生型BRAF的活性。这可能是因为野生型BRAF无法被高效地招募至E3连接酶复合体进行泛素化和降解。
9. TPD作用较少依赖于组织分布
相较于传统的抑制剂,蛋白降解剂不需要在某些组织中(如大脑)的高水平分布。因为TPD不需要药物饱和,并且可以在低配体浓度下累积药理作用,这为治疗需要穿越血脑屏障、但却受限于药物分子量大的疾病(例如多发性硬化、脑转移病变)提供了可能性。
比如,Nurix公司的第二代BTK降解剂NX-5948,据报道其对大脑的渗透率不到5%,但在小胶质细胞中却具有活性。在小鼠模型中,NX-5948能够显著降低动物大脑中的肿瘤负担,并且延长动物的生命。1a期试验的临床生物标志物数据证明了该疗法可以使BTK快速、稳健和持续地降解。
另一个例子是C4 Therapeutics和罗氏共同开发的CFT8919,这是一种具有口服生物利用度的变构BiDAC降解剂,对携带EGFR L858R突变的肿瘤具有良好的活性和选择性。在临床前研究中,CFT8919在EGFR L858R驱动的非小细胞肺癌(NSCLC)的体内外模型中具有活性,可靶向广泛的在靶耐药突变并有颅内活性,具有预防或治疗患者脑转移的潜力。
10. 难以找到配体的蛋白质也能间接地被降解
最后,TPD也能够导致传统上难以找到配体的靶标被间接地降解。纽约西奈山医学院(Mount Sinai School of Medicine)的研究人员开发出了一种创新PROTAC策略“桥接PROTAC”,该方法利用与目标蛋白相互作用的蛋白质的小分子配体,将蛋白质复合物招募到E3泛素连接酶附近,以靶向缺乏小分子配体的蛋白质。基于这种桥接PROTAC策略,研究人员开发了细胞周期蛋白D1(Cyclin D1)的降解剂MS28。Cyclin D1是癌症治疗中的一种重要靶点,但目前还没有报道其小分子配体,传统的PROTAC策略对它不适用。
已知Cyclin D1可以与CDK4/6形成蛋白复合物,而针对CDK4/6的高选择性、高效小分子抑制剂已经面世,据此,研究人员将CDK4/6抑制剂通过连接子(linker)连接到E3泛素连接酶的配体上,利用CDK4/6招募Cyclin D使其降解。
经检测,MS28能有效降解Cyclin D1,并且其降解速度比CDK4/6快。此外,MS28还比CDK4/6抑制剂和降解剂更有效地抑制癌细胞的增殖。

TPD未来的方向
TPD是药物发现历程中具有革命性意义的创新策略,其未来潜力令人瞩目。首先,在一系列的临床前和临床研究中,TPD展现出与传统小分子不同的作用机制和疗效,这有望为TPD在药物研发领域开拓更广阔的应用范围。
TPD领域的新研究不断涌现,带来了许多新的机遇。比如,可透过血脑屏障的蛋白降解剂的出现,为神经疾病治疗提供了全新的可能性。针对跨膜和细胞外蛋白降解剂的研发,可以靶向EGFR、PCSK9和SLC转运蛋白等靶点,这可能会对各类疾病的治疗可能产生深远影响。此外,针对像STAT3这样难以靶向的蛋白质类别的概念验证,也揭示了TPD有能力触及那些之前被认为“无法成药”的靶标。
此外,新的连接酶(如DCAF1)的运用、新结合位点的发现(比如AR的变构位点)和新型活性分子的使用(如共价和可逆降解剂),都在提高TPD的多功能性和有效性。
最后,Orum Therapeutics公司的总裁及首席执行官SJ Lee博士曾在访谈中指出,我们将看到既定的治疗模式出现更多创造性融合,抗体和TPD的融合将在15年后成为主流。随着这些新策略的广泛应用,我们期待看到更多与传统小分子药物有着显著差异的降解剂问世。
总之,我们期待TPD继续繁荣发展,不仅在药物发现领域开辟新天地,同时进一步彻底改变众多医学领域的治疗格局。































