2023年04月,美国密苏里州圣路易斯华盛顿大学医学院Logan Brase团队在《Nature communications》上发表了题为“Single-nucleus RNA-sequencing of autosomal dominant Alzheimer disease and risk variant carriers”的文章,文章通过单细胞核转录组测序(snRNA-seq)等方法分析了阿尔茨海默病(AD)病人脑细胞中的基因表达差异,证明了单个AD致病因素变异可以影响多种脑细胞类型的转录,解释了AD的遗传结构和细胞异质性导致的转录多样性。
下面跟着元小新一起学习充电吧~

01
用单细胞技术解决了什么问题?
通过单核转录组分析了阿尔茨海默病病人的遗传结构、脑细胞异质性及其转录多样性,发现单个阿尔茨海默病风险变异可以影响包括神经元、小胶质细胞和少突胶质细胞在内的多种脑细胞的转录,指出这些变化会改变阿尔茨海默病的病理进展和临床表现。
02
实验亮点
本研究选取了多种不同类型的阿尔茨海默病病人的脑组织,利用遗传和单细胞分子数据来了解介导AD遗传风险因素的途径、生物过程以及细胞类型的异质性,表明遗传变异影响细胞表达状态,从而导致了疾病的异质性。
03
临床意义
研究提供了对AD遗传结构和细胞异质性导致的转录多样性的新见解,对AD的个性化治疗提供新思路。
思维导图
研究背景
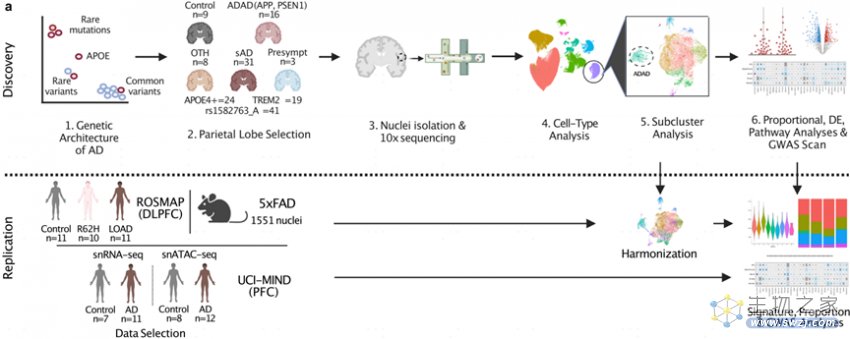
阿尔茨海默病(AD)是一种神经退行性疾病,以淀粉样蛋白(Aβ)斑块和神经原纤维缠结(NFT、Tau沉积物)为主要特征。常染色体显性遗传性AD(ADAD)与淀粉样蛋白前体蛋白(APP)、早老素1(PSEN1)和早老素2(PSEN2)等基因有关;散发性AD(sAD)的主要致病因素载脂蛋白E(APOE)ε4与星形胶质细胞、小胶质细胞介导的胆固醇代谢和Aβ清除有关;TREM2(一种驱动小胶质细胞活化的基因)的低频变异会增加患AD风险;MS4A位点中的基因间变异——rs1582763与较高的脑脊液(CSF)可溶性TREM2水平相关。
研究结果
1.AD的转录多样性
作者对患者的顶叶前体取样进行整合分析,鉴别出六种主要的细胞类型:神经元(Neuron),少突胶质细胞前体细胞(OPC),少突胶质细胞(Oligo),星形胶质细胞(Astro),内皮细胞(Endo)和小胶质细胞(Micro)(图1b,c)。总体来说,胶质细胞占细胞核总数的80.7%,而神经元细胞核占18.2%,这与组织学和生物信息学上的细胞组成一致。
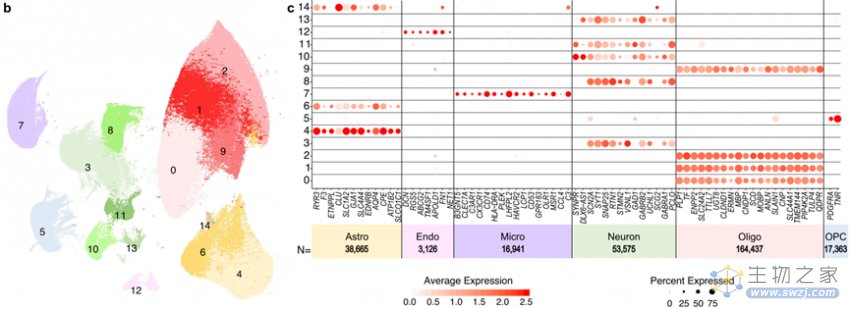
图1 通过snRNA-seq分析人类大脑的主要细胞类型
研究比较了sAD、TREM2、ADAD组的细胞类型特异性基因表达模式,发现星形胶质细胞、兴奋性神经元和OPC在各组间表现出低转录的趋势,而小胶质细胞和少突胶质细胞则过表达(图2a),表明AD使星形胶质细胞、兴奋性神经元和OPC丧失功能,使小胶质细胞和少突胶质细胞功能性增加。
差异基因表达分析发现sAD和ADAD组的DEG表达变化基本一致,这种变化在ADAD中往往更强(图2b)。ADAD组的星形胶质细胞中,与血脑屏障运输相关的SLC7A5、LRP2和SLC7A1基因以及与细胞外基质组织相关的ITGA10、P3H2、PLOD3等基因过表达。TREM2组的OPC中,中枢碳代谢相关的PDGFRB、PFKP和PDK1基因过表达。在AD各组兴奋性神经元中,胆固醇稳态相关的EHD1、DGAT2和LDLRAP1等基因过表达。
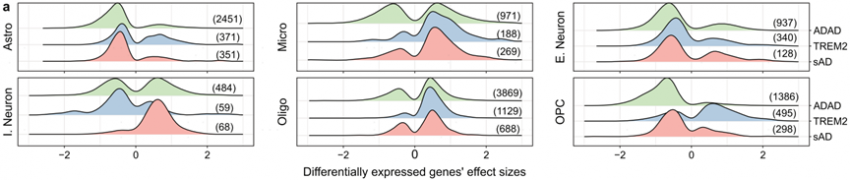
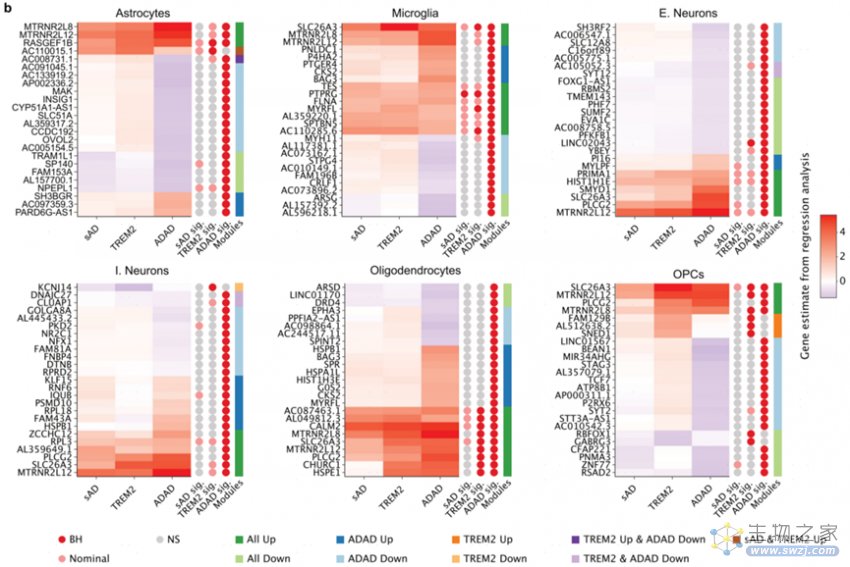
图2 ADAD、TREM2和sAD组细胞类型表达模式的异同
作者发现ADAD组富集所有细胞状态,Astro.2和Astro.4(Astro-DAA)两种星形胶质细胞状态是ADAD所特有的,与其他星形胶质细胞状态相比,Astro.4中VIM、CTSB和OSMR的表达增加(图4f);Mic.4(Mic-stress)中MECP2的表达显著增加(图4h)。通路分析显示Mic.4中491个上调基因与细胞应激反应的调节和受体介导的内吞作用有关,Oligo.3(Oligo-spliceosome)上调基因中富集了mRNA剪接相关的基因(图3g),主要是与晚发性AD有关的核不均一核糖核蛋白(HNRNP)(图4i)。
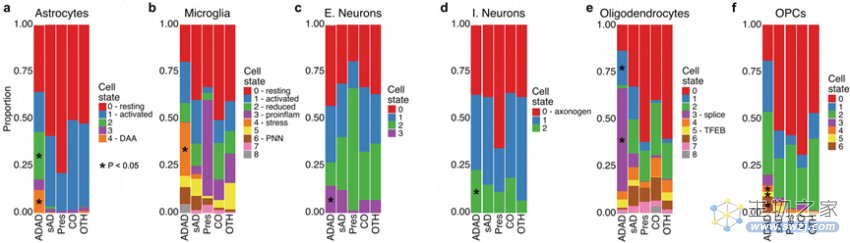
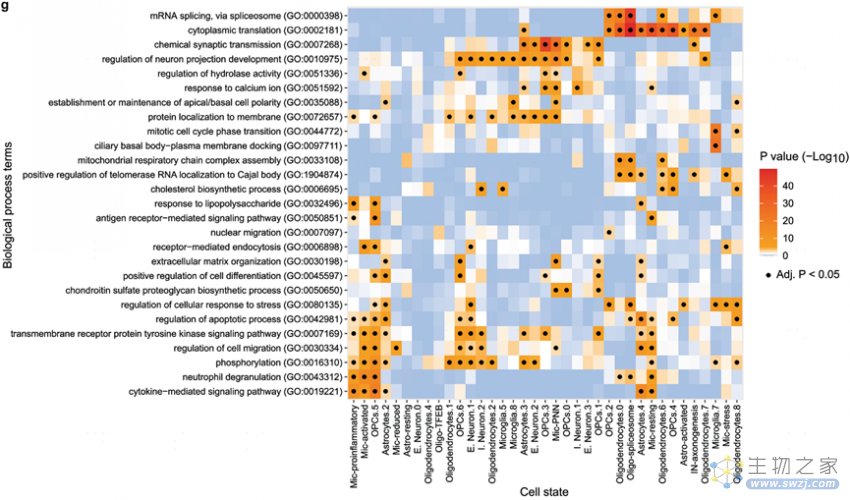
图3 ADAD组在多种细胞类型中表现出明显的特征
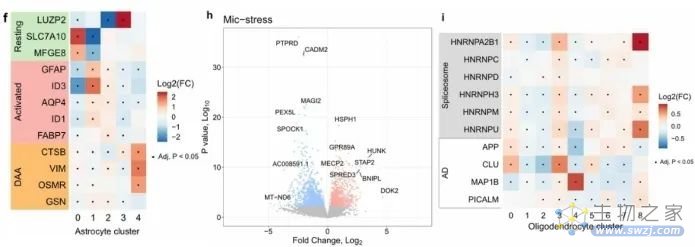
图4 不同细胞状态下的基因表达情况
2.TREM2变异体调节小胶质细胞和少突胶质细胞的转录状态
研究发现与细胞活化减少相关的TREM2 AD变异(p.R47H、p.R62H和p.H157Y)与Mic.2(Mic-reduced)相关(图5a)。与Mic.0(Mic-resting)和Mic.1(Mic-activated)相比,Mic.2组高表达静息状态小胶质细胞标记基因,并最低限度表达激活状态标记基因(图5b)。TREM2组富集更多Oligo.5(Oligo-TFEB;图5e)。此外,研究发现SOX8、SREBF1和NKX6-2与髓鞘相关,NFE2L2/NRF2与多种AD病理相关(Aβ、Tau和氧化应激等),而ZNF518A与AD少突胶质细胞的体细胞突变负担增加相关(图5)。
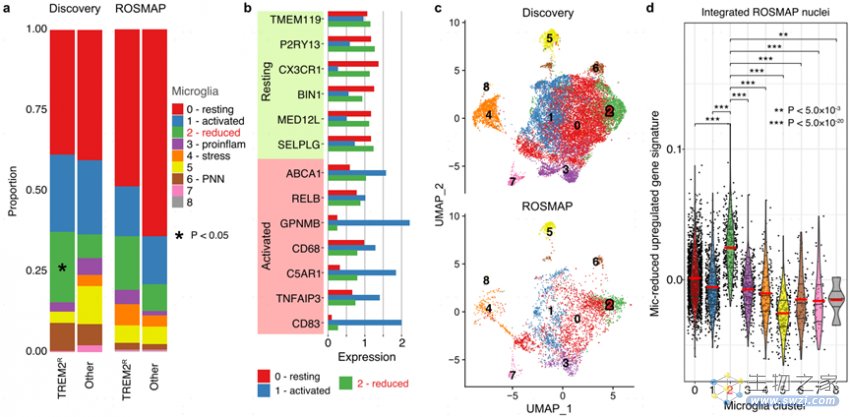
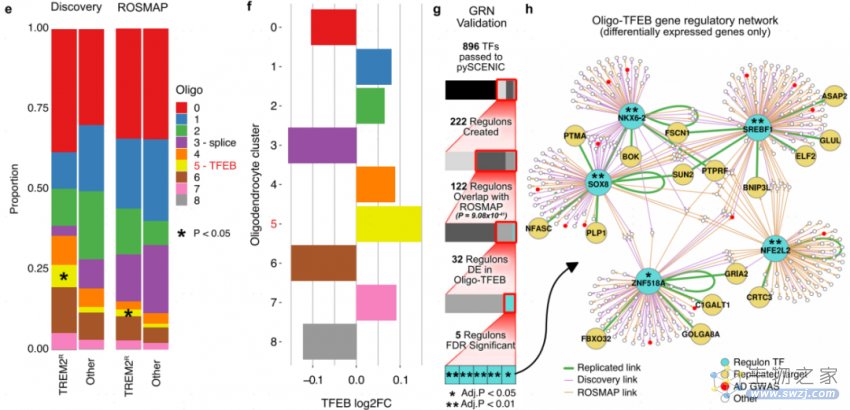
图5 TREM2变异体不同的小胶质细胞和少突胶质细胞谱
3.MS4A弹性变异载体表现出特异性的炎性小胶质细胞激活状态
rs1582763-A与AD患病风险降低和脑脊液sTREM2水平升高相关,rs1582763-A组Mic.3(Mic-proinflammatory)细胞核增加(图6a)。Mic.1中(Mic-activated)活化的小胶质细胞基因(CD68、CD83、TNFAIP3等)表达上调(图5b);ACVR1和BMPR2的表达增加,表明BMP信号增强。Mic.3中IL1B、CD14、FCGR3A、CD40等基因表达上调(图6b),表明了促炎特征;同时,Mic.3还高表达TGFBR1和TGFBR2,表明TGF-β信号传导增加(图6c)。TMEM163的表达也增加,TMEM163参与锌转运到细胞内的过程,从而使锌影响活性氧(ROS)水平,活性氧引起神经元基因组损伤,导致AD患者的细胞死亡。此外,MS4A基因在星形胶质细胞中不表达,提示细胞串扰同步激活小胶质细胞和星形胶质细胞。
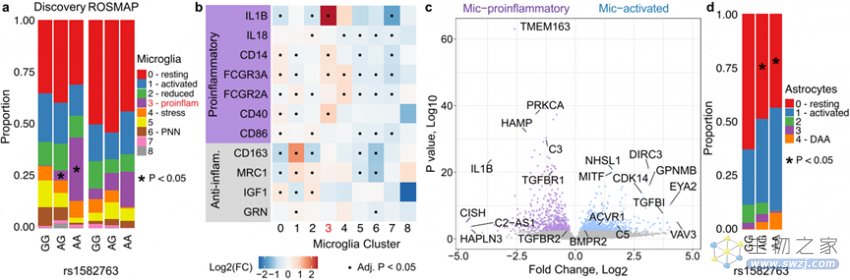
图6 MS4A rs1582763携带者独特的小胶质细胞和星形细胞特征
4.APOEε4携带者在抑制性神经元中易发生铁死亡
研究发现APOEε4组的小胶质细胞和抑制性神经元细胞状态的比例降低。Mic.6(Mic-PNN)中与细胞外基质组织和硫酸软骨素蛋白多糖生物合成过程相关的基因上调(图3g),表明周围神经网络(PNN)和可塑性。IN.0(IN-axonogenesis)中参与细胞质翻译和轴突发生的基因上调(图3g)。APOEε4携带者的IN.0中与铁死亡相关的基因PRNP和GPX4表达上调,因此推测铁死亡导致该细胞状态下APOEε4+细胞核的减少。
结论
本研究证明了单个AD致病因素变异会影响多种脑细胞类型的转录。APP和PSEN1的致病性突变改变了神经元的特征,但与对照组和sAD组相比,胶质细胞的特征更明显。TREM2变异改变了小胶质细胞和少突胶质细胞的特征,而MS4A变异增强了小胶质细胞的促炎特性。这些变化都可以改变AD的病理进展和临床表现,阐明了导致疾病异质性的功能机制,为AD的个性化诊疗提供新思路。
参考文献
Brase L, You SF, D'Oliveira Albanus R, et al. Single-nucleus RNA-sequencing of autosomal dominant Alzheimer disease and risk variant carriers. Nat Commun. 2023 Apr 21;14(1):2314. doi: 10.1038/s41467-023-37437-5. PMID: 37085492; PMCID: PMC10121712.































