黏连蛋白(cohesin)是一种蛋白质复合物,主要由四个核心亚基组成,包括SMC1、SMC3、STAG1/2和RAD21。它在细胞分裂过程中起着重要的作用,参与染色体的结构维持、有丝分裂的准备、染色体分离等关键过程。
在有丝分裂前期,黏连蛋白会把染色体的姐妹染色单体紧密地连接在一起,形成了称为染色体联会的结构。这有助于确保在有丝分裂时,每个染色体都能正确地被复制和分离,以保证遗传信息的准确传递。此外,黏连蛋白还参与了许多其他生物学过程,如DNA损伤修复、基因表达和基因组拓扑结构的维持等。
但现在,美国国家癌症研究所(National Cancer Institute,NCI)的研究人员发现,这种蛋白质复合物还有另一个功能,这种功能可以回答癌症研究人员数十年来的一些困扰。
Science Advances上3月1日发表的一项研究“Cohesin regulates alternative splicing”表明,黏连蛋白对选择性剪接(alternative splicing,也叫可变剪接)具有调节作用。

图1 研究成果(图源:[1])
研究的作者之一、NCI的免疫学家Dinah Singer表示:“在急性骨髓性白血病(Acute myeloid leukemia,AML)的原发患者细胞中,存在黏连蛋白突变,从而导致剪接发生改变。”已经证实,在某些情况下,选择性剪接的异常调控可能导致癌症的发生和发展。这暗示,黏连蛋白在AML和其他类型的癌症的发展中也发挥了作用。“因此,我们有可能逆转生长表型,并在未来开展新的治疗途径。”
在转录过程中,基因的编码区如果出现了不同的组合方式,就能够在不同的细胞类型或发育阶段中编码多种不同的蛋白质,这一现象就被称作选择性剪接。选择性剪接对于包括细胞发育和死亡在内的许多细胞过程都非常重要。
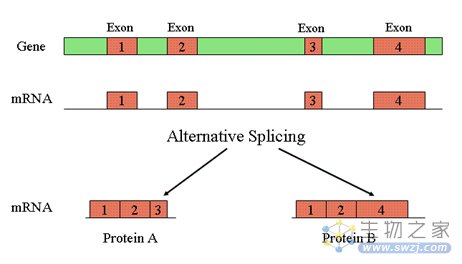
图2 选择性剪接示意图(图源:NCBI)
高达95%的编码蛋白基因会发生选择性剪接。当剪接发生突变时,剪接位点上的核苷酸会被插入或删除。这些剪接突变与AML中的一系列基因变异有关,其中20%的病例还表现出凝聚素突变。这促使研究人员调查黏连蛋白突变是否与选择性剪接相关联。
在这项研究中,Dinah和她的同事们通过诱导黏连蛋白的核心成分——RAD21的降解,来耗尽人类直肠癌细胞系(HCT116细胞)中的黏连蛋白。当他们使用 RNA 测序研究这种耗尽对剪接模式的影响时,他们发现与对照组相比,黏连蛋白耗尽的细胞系中,各种不同形式的选择性剪接均受到显著影响。
研究人员比较了HCT116细胞在黏连蛋白耗尽或未耗尽的情况下转录率的差异,发现黏连蛋白不是通过影响转录来间接影响剪接的。使用邻近连接分析(Proximity ligation assays,PLAs)技术,研究人员观察到黏连蛋白的RAD21亚基与剪接因子U1-70、调节剪接因子FUS的共定位,这说明黏连蛋白直接和剪接因子相互作用。
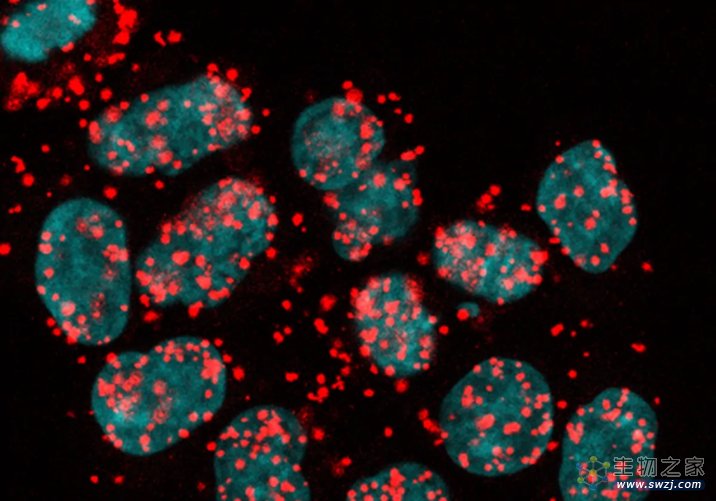
图3 正常条件下黏连蛋白亚基RAD21和剪接因子U1-70的显微镜图像(图源:[2])
先前的研究发现,溴结构域蛋白BRD4与黏连蛋白有许多功能相似之处,都在整个细胞周期中发挥作用,此外,BRD4 还有助于调节细胞内和体内的选择性剪接。
那么,BRD4与黏连蛋白是否相互合作来调节剪接呢?
研究人员单独或一起耗尽了细胞中的BRD4与黏连蛋白,发现,单独耗尽和同时耗尽的剪接模式并不相同,即BRD4与黏连蛋白各自调节了一部分的剪接,同时还共同调节另一部分的剪接。PLAs和免疫共沉淀的结果,以及重组黏连蛋白与重组BRD4结合能力的测试结果则进一步表明,黏连蛋白直接与BRD4相互作用。
研究人员还通过使用独立的、公开可用的患者样本RNA测序数据集研究了黏连蛋白在AML中的作用。用于分析的三组数据中,第一组患者黏连蛋白发生突变但剪接因子没有发生突变,第二组患者剪接因子发生突变但黏连蛋白没有发生突变,第三组对照组黏连蛋白和剪接因子都未发生突变。若黏连蛋白突变不是影响选择性剪接的一个因素,则第一组和第三组的剪接模式应该没有差异。结果发现,在具有黏连蛋白突变的样本中观察到独特的剪接模式。
为了进一步证明黏连蛋白突变直接影响选择性剪接,研究人员分析了两个经过单点突变改造的小鼠胚胎干细胞克隆,结果观察到与剪接因子的相互作用减少并改变了剪接模式,证明了因果关系。
瑞典隆德大学癌症中心医学遗传学家Kajsa Paulsson评价这项研究说:“新发现的黏连蛋白的这种功能非常令人兴奋。黏连蛋白与多种常见癌症类型有关,但其潜在机制仍然是个谜。了解这些突变,将是推进靶向治疗开发的一大步。”
有了这项发现,科学家们可以更深入地研究黏连蛋白在癌症发生和发展中的作用。这也意味着我们可以通过针对黏连蛋白来治疗AML和其他类型的癌症。
不过,这项研究仍然存在一些局限性。例如,科学家们只使用了少量的AML患者样本,需要更多的研究来确认这些发现是否普遍存在于其他癌症类型中。此外,这项研究并没有研究黏连蛋白的具体机制,这是下一步的研究方向。
总的来说,这项研究为我们提供了一个新的视角来理解癌症的发生和发展。通过发现黏连蛋白的另一种功能,科学家们可以探究更多与癌症相关的问题,并开发新的治疗方法。
参考资料:
[1]Singh AK, Chen Q, Nguyen C, et al. Cohesin regulates alternative splicing. Sci Adv. 2023 Mar;9(9):eade3876. doi: 10.1126/sciadv.ade3876.
[2]https://www.the-scientist.com/news-opinion/mutated-cohesin-throws-dna-splicing-out-of-whack-resulting-in-cancer-70998































