
肠道内分泌细胞(enteroendocrine cells, EECs)是存在于胃、小肠和结肠上皮中的激素分泌细胞,与其他上皮细胞谱系一样,来源于区域特定的Lgr5+肠道干细胞(intestinal stem cells, ISCs)。EECs调节肠道代谢活动的多个方面,包括胰岛素水平、饱腹感、胃肠道分泌和运动等。不同EEC谱系如何产生尚不完全清楚,肠道干细胞的命运决定也一直是发育生物学领域的热点问题。
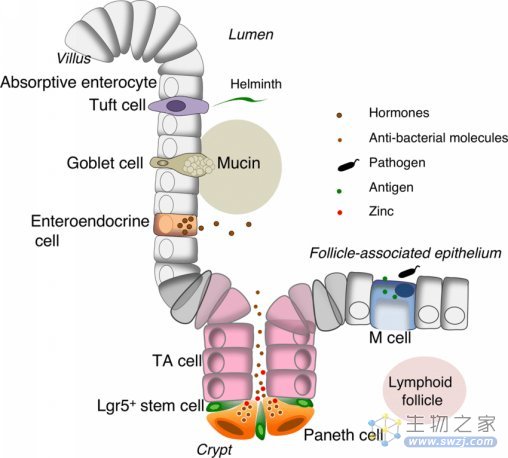
小肠肠道细胞类型示意图
(下文还会看到Goblet cell:杯状细胞、Paneth cell:潘氏细胞)
图片来源:DOI:10.1007/s10620-019-05561-2
EEC谱系与ISCs的平衡分化受转录因子(transcription factors, TFs)网络调控。RNA测序和类器官技术阐明了EEC发展过程中基因表达谱的时间层次。通过将Neurog3(内分泌发育的主要调节因子)作为时间分辨的报告基因,在单细胞水平构建了小鼠体内EEC分化的实时和谱系特异性图谱。NEUROG3的过表达可以产生内分泌细胞,用于人胰腺导管细胞的功能表征。人肠道类器官技术的不断进步,使得科学家们能够在近端至远端胃肠轴上对EEC亚型进行分析。小鼠中调控EEC亚型的TF,同样在人肠道类器官中得到证实,这揭示了保守的NEUROG3下游调节机制。然而,小鼠和人的EEC分化调控机制也存在差异。此外,NEUROG3上游的调控机制和调控NEUROG3表达的内源性抑制因子尚不清楚。
类器官助力生命医学研究
类器官(Organoids)指通过体外三维培养而形成的迷你细胞团,能够分化成多种功能细胞,从而模拟体内器官。因此,类器官也称为“迷你器官”。类器官可以来源于成体干细胞、多能干细胞以及肿瘤组织。科学家们经过多年的不懈努力,已经陆续开发出了肠道、视网膜、肝脏、乳腺等多种类器官。
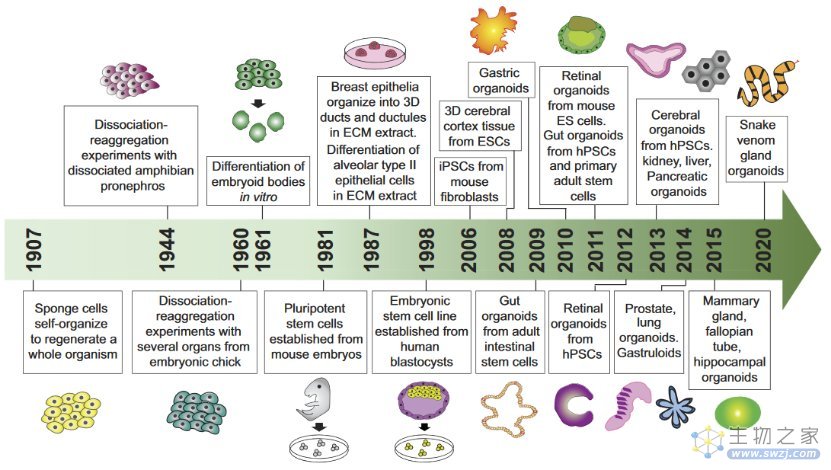
类器官发展历程
DOI: 10.1152/ajpcell.00120.2020.
2009年,荷兰Hans Clevers 团队使用来自小鼠肠道干细胞培育出首个肠道类器官,开启了类器官领域的元年。此后,类器官广泛应用于精准医学、药物研发和疾病研究。比如,荷兰Merus NV公司与西班牙巴塞罗那科学技术研究院合作,使用来自癌症患者的类器官库对500多个双特异性抗体进行筛选,从中发现了名为 MCLA-158 的 EGFR × LGR5 双特性抗体,能够有效抑制结直肠癌类器官的生长,并抑制癌症转移,相关研究成果于2022年4月发表在Nature杂志上。

DOI: 10.1038/s43018-022-00359-0
近期,来自荷兰皇家艺术与科学学院的“类器官之父”Hans Clevers团队建立了一种基于类器官的基因筛选平台,发现ZNF800是一个全新的抑制EEC分化的转录因子。该成果以《Unbiased transcription factor CRISPR screen identifies ZNF800 as master repressor of enteroendocrine differentiation》为题,于2023年10月27日队发表在Science杂志上。

DOI: 10.1126/science.adi2246
结合类器官和CRISPR技术
研究团队利用慢病毒递送系统,在人小肠类器官中构建了CRISPR基因敲除文库,该文库包括7210个sgRNA(靶向1800个人类转录因子),以及100个sgRNA阴性对照。通过荧光标记(CHGA-IRES-iRFP670:EEC,MUC2-mNeongreen:杯状细胞,DEFA5-IRES-dsRed:潘氏细胞),研究人员分离出EEC、杯状细胞和无荧光标记的细胞,评估sgRNA在基因组中的插入情况。
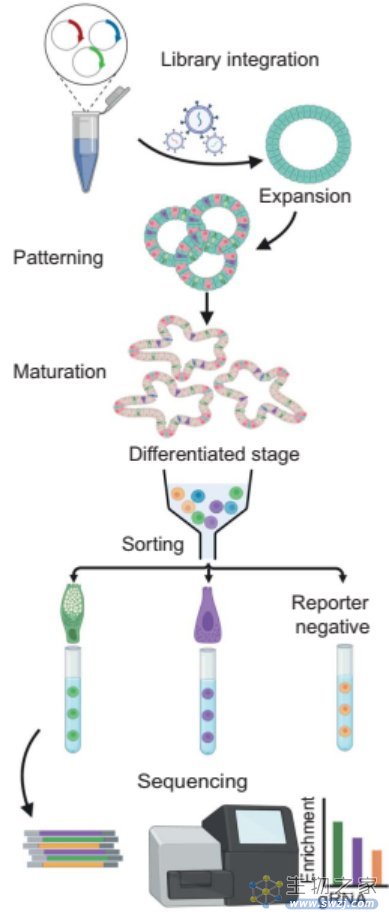
类器官CRISPR筛选示意图
DOI: 10.1126/science.adi2246
发现ZNF800抑制EEC分化
基于上述的筛选平台,研究团队发现了已知的TF(NEUROG3,INSM1,SOX4)和新的TF(NFIC, TEF, ZHX2),并发现了一种全新的EEC分化的抑制因子ZNF800。ZNF800在小肠和大肠中广泛表达,在敲除ZNF800的小肠类器官中,荧光报告系统显示,EEC数量升高,杯状细胞和潘氏细胞数量急剧下降。进一步的单细胞RNA测序结果,也验证了上述表型。而且,EEC的类型主要为肠嗜铬细胞(enterochromaffin cell)。
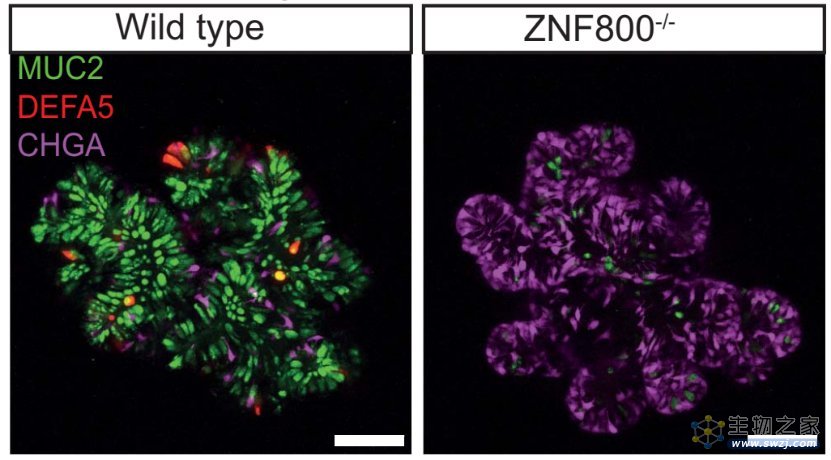
野生型(左)和ZNF800敲除(右)的人小肠类器官
(绿色:杯状细胞、红色:潘氏细胞、紫色:EEC)
DOI: 10.1126/science.adi2246
证实PAX4是ZNF800的下游靶点
科研人员进一步解析了ZNF800调控ECC分化的机制,发现NEUROG3,INSM1和PAX4是ZNF800下游靶点。通过对PAX4的进一步研究发现,ZNF800可以直接调控PAX4来限制肠嗜铬细胞的分化。此外,PAX4还通过单方面抑制一种EEC亚型TF(ARX),来调控其他EEC亚型的分化。
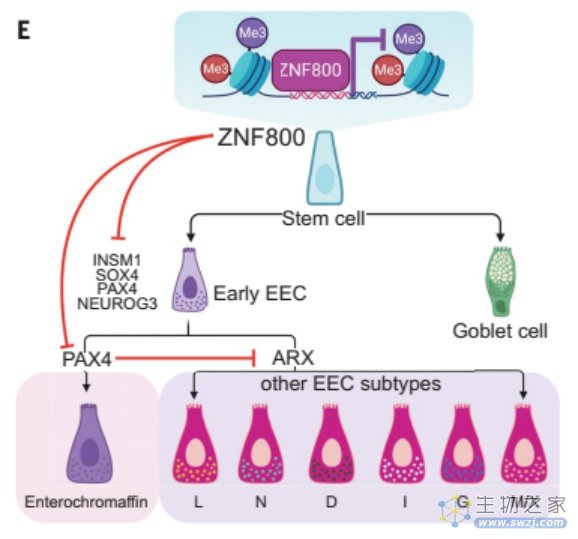
ZNF800调控EEC分化机制的示意图
DOI: 10.1126/science.adi2246
本文的临床意义
Hans Clevers团基于人小肠类器官与人体器官的高度相似性,对EEC谱系分化的调控因子进行CRIPSR筛选。研究人员发现,ZNF800既可以通过下游靶点INSM1, SOX4和NEUROG3影响EEC早期分化,也可以通过下游靶点PAX4调控肠嗜铬细胞和其他EEC亚型分化。作者还推测,ZNF800可能通过上述机制来调控人胰腺β细胞分化,暗示了ZNF800在糖尿病研究中可能具有价值。本文的研究成果,为胃肠疾病和内分泌疾病研究提供了关键线索,为开发新的治疗方案和药物奠定了基础。
参考文献:
1. Lin Lin et al. Unbiased transcription factor CRISPR screen identifies ZNF800 as master repressor of enteroendocrine differentiation. Science 382, 451-458 (2023).
2. Ohashi, W., Hara, T., Takagishi, T. et al. Maintenance of Intestinal Epithelial Homeostasis by Zinc Transporters. Dig Dis Sci 64, 2404–2415 (2019).
3. Am J Physiol Cell Physiol 319: C151–C165, 2020.
4. https://www.nature.com/articles/s43018-022-00359-0































