造血干细胞(HSC)存在于我们的骨髓中,它们通过自身的自我更新能力在骨髓中分裂产生血液和免疫系统的所有细胞。造血干细胞移植(HSCT),是用健康的造血干细胞替代患病的造血干细胞,可以治疗非恶性造血疾病,例如血红蛋白病和免疫缺陷。非恶性造血疾病可以用同种异体造血干细胞(来自患者的亲属或无血缘关系的人)移植治愈,但只有一小部分患者有合适的免疫配型,以尽量减少移植物抗宿主病(GvHD)的潜在致命并发症。
基因治疗可以通过使用自体造血干细胞(来自患者自身)消除GvHD的风险并纠正非恶性造血疾病,并通过基因导入或基因编辑来替代遗传缺陷。目前的造血基因治疗需要从患者自身分离造血干细胞,并在体外通过慢病毒递送载体或使用电穿孔技术进行基因导入或基因编辑。除了这些复杂的流程外,移植前还需要通过化疗或放疗消除患者体内自身的造血干细胞,为接下来的移植造血干细胞提供空间,这一过程会带来大量急性或慢性全身毒性作用。
因此,研究人员一直在寻找造血干细胞基因治疗的圣杯——安全的在体内进行造血干细胞基因组编辑。
2023年7月27日,宾夕法尼亚大学佩雷尔曼医学院、宾夕法尼亚儿童医院的研究人员在 Science 期刊发表了题为:In vivo hematopoietic stem cell modification by mRNA delivery 的研究论文。
我们开发了CD117/LNP-mRNA平台,使用CD117抗体修饰脂质纳米颗粒(LNP)表面,使其特异性靶向造血干细胞(HSC),使用该平台递送mRNA形式的腺嘌呤碱基编辑器(ABE),能够高效修正镰状细胞病基因突变。
此外,注射CD117/LNP递送促凋亡蛋白PUMA的mRNA,能够通过静脉注射直接在体内靶向并导致造血干细胞(HSC)凋亡,实现对造血干细胞移植(HSCT)前的无遗传毒性的调控,该平台为体内基因编辑治疗遗传性疾病奠定了基础。

诺贝尔化学奖得主、CRISPR基因编辑技术奠基人之一的 Jennifer Doudna 教授认为,要想实现CRISPR的全部潜力,面临的最大挑战可以说是改善体内递送。这对于开发可负担的和可获得的基因编辑疗法非常重要。今年4月份,她的团队发表了一份预印本论文【2】,展示了利用包膜递送载体(EDV)进行细胞特异性递送,从而实现体外和体内的基因组编辑。为了使CRISPR成为已知的所有疾病的标准治疗方法,我们需要能够精确地靶向更多的细胞和组织类型。
在这项发表于 Science 的最新研究中,研究团队使用脂质纳米颗粒(LNP)递送mRNA形式的Cas9基因编辑系统,通过在LNP上装载CD117抗体,靶向造血干细胞(HSC)表面的CD117。
实际上,这项研究是建立在2022年1月份 Science 发表的一项研究的基础上【3】,在这项研究中,宾夕法尼亚大学佩雷尔曼医学院的研究人员开发了一种在体内生成的瞬时工程化CAR-T细胞疗法,通过注射脂质纳米颗粒(LNP)递送的mRNA,重编程T细胞,使其识别心脏纤维化细胞,进而减少纤维化,恢复心力衰竭小鼠模型的心脏功能。
该方法类似于mRNA疫苗,仅需一次注射,就能在体内生成CAR-T细胞疗法,有望解决目前CAR-T疗法工艺复杂、周期长、价格高昂的难题。
详情:注射一针mRNA,直接在体内生成CAR-T,一针修复心脏

这种LNP-mRNA方法的美妙之处在于它是一个高度模块化的平台,我们能够对LNP进行修饰,使其靶向特定细胞类型,还可以修改其携带的mRNA,从而设计出个性化且更具安全性的新疗法。
以LNP为基础的递送面临的主要限制是它很容易向肝脏富集,在对于治疗肝脏相关疾病是一个优点,例如遗传性转甲状腺素蛋白淀粉样变性(hATTR)、家族性高胆固醇血症(HeFH)等等。但对于肝外递送,这就成了一大障碍。在这项研究中,研究团队通过将CD117抗体结合到LNP表面,提高其对造血干细胞(HSC)的靶向效率。
在体外验证实验中,LNP可以将各种基因编辑系统递送到造血干细胞中,而CD117/LNP系统递送的腺嘌呤碱基编辑系统(ABE),对镰状细胞病基因突变的修正超过目前作为金标准的电穿孔技术。
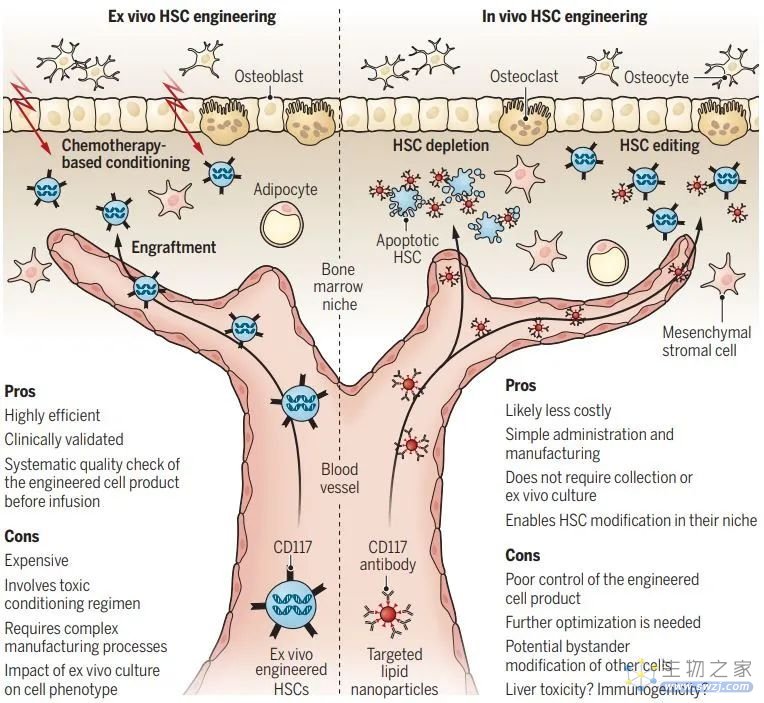
体外造血干细胞基因工程(左)与体内造血干细胞基因工程(右)的比较
接下来,研究团队在小鼠模型中进行了体内实验验证。研究团队使用CD117/LNP递送了促凋亡蛋白PUMA的mRNA,PUMA是p53上调凋亡调节因子,能够让细胞发生凋亡。通过这种方式,能够实现对骨髓中造血干细胞的特异性清除,有望取代造血干细胞移植前的放化疗,减少毒副作用。
传统上,CAR-T细胞是通过基于逆转录病毒或慢病毒的方法进行的,这种方法会产生更持久的CAR-T细胞,癌症患者在接受治疗超过10年时间后仍显示出持续疗效。而这项最新研究所开发的新方法的应用之一是在造血干细胞移植前的放化疗清髓处理,只需要注射LNP-mRNA就能够实现特异性清除骨髓中的造血干细胞,而且这种方式是瞬时的,达到效果后,LNP和mRNA会降解掉。
总的来说,该研究开发了一个LNP-mRNA技术平台,通过静脉注射LNP将mRNA递送到骨髓中的造血干细胞,促进基因编辑和骨髓移植。无需传统复杂且危险的骨髓移植方法,就能在患者体内编辑造血干细胞,这为许多遗传疾病带来了新的希望。
论文链接:
1. https://www.science.org/doi/10.1126/science.ade6967
2. https://www.biorxiv.org/content/10.1101/2022.08.24.505004v2
3. https://www.science.org/doi/10.1126/science.abm0594































