有这样一种“神药”,全世界约有1.5亿人在服用它,具有多种神奇功效,但药价并不昂贵——它就是二甲双胍。
二甲双胍是目前治疗2型糖尿病的一线药物,临床应用已超过60年。因其良好的降糖效果并配合降低体重、较好的安全性以及心血管保护等特点,二甲双胍被多个指南推荐为2型糖尿病控制高血糖的基础治疗药物,在临床上有着“无可撼动”的地位。
随着日渐丰富的临床应用证据,《二甲双胍临床应用专家共识(2023年版)》于今年6月2日重磅发布。其中特别提到了,二甲双胍之所以能“封神”,很大一部分原因是该药还在降糖外的领域“大放异彩”,比如:减重、心血管保护、降血脂、抗肿瘤、改善认知功能等等。
鉴于各种有益效果以及较高的安全性,二甲双胍已被推荐给没有糖尿病的人群。但所谓“药无完药”,神药也有“翻车”的时候。近日,来自浙江大学医学院的研究团队揭示了二甲双胍的“阴暗面”——或具有肾毒性。
研究者发现,即使是低剂量的二甲双胍,也会加剧急性肾损伤(AKI),并增加小鼠的死亡率。从机理上来看,在AKI发生后使用二甲双胍,会通过铁死亡途径诱导肾实质细胞的程序性死亡以及中性粒细胞的扩增,从而加重肾脏疾病。

https://doi.org/10.1038/s41421-023-00595-3
作为慢性病发展的最大风险因素之一,衰老成为了越来越多科研的基础以及靶向。现阶段已有研究证明,二甲双胍(Met)、烟酰胺(NA)、白藜芦醇(Res)、雷帕霉素(Rap)和希诺裂(Sen)均是延长寿命和改善健康的药物,于是研究者对比了5种长寿药物是否可作为治疗AKI的候选药物。
研究者采用肾缺血再灌注(I/R)诱导了小鼠模型中的AKI,在对比了不同药物单独治疗的数据后显示,除了二甲双胍,其余四种药NA、Res、Rap和Sen都对AKI有一定的保护作用,仅二甲双胍没有。
值得注意的是,研究者选择了2种剂量的二甲双胍——低剂量(50mg/kg和100mg/kg)和高剂量(200mg/kg)。
结果显示,仅低剂量的二甲双胍就能加重I/R诱导的AKI,在24小时内导致50%的死亡;而高剂量地使用二甲双胍,则在横纹肌溶解诱导的AKI模型中造成了100%的致死率。
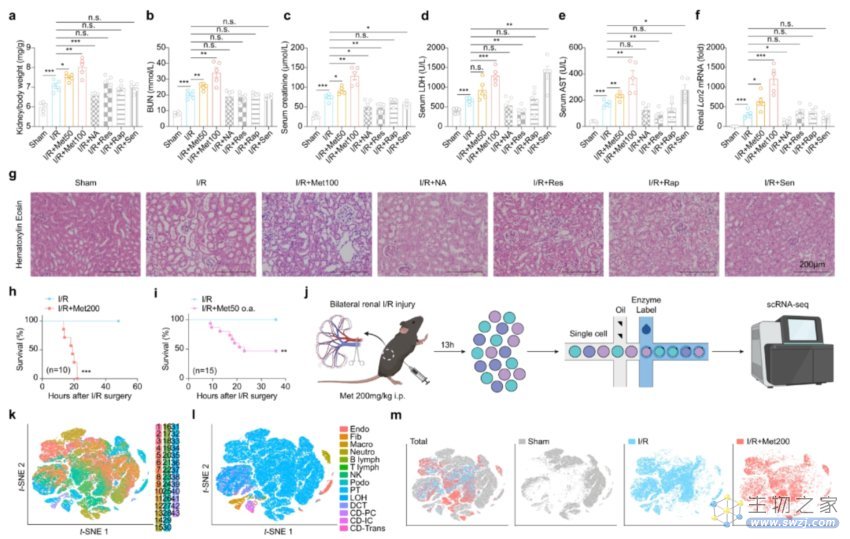
二甲双胍以剂量依赖的方式加剧了小鼠模型中的AKI
那么,二甲双胍究竟是如何诱导肾毒性的呢?为了探究深层原因,研究者采用单细胞RNA测序(scRNA-seq)对小鼠肾脏中分离出的细胞进行监测。
与对照组相比,经过二甲双胍治疗的I/R小鼠的细胞数量减少了三分之一左右,其中肾实质细胞明显减少。同时,研究者在AKI模型中观察到多种形式的调节性细胞死亡,包括细胞凋亡、坏死和铁死亡。
换言之,二甲双胍加重的肾毒性会导致肾实质细胞的多种形式的程序性细胞死亡。而通过对肾实质细胞的KEGG通路分析后发现,虽然多种细胞死亡通路均发生了显著变化,但其中变化最大的为:铁死亡。
相反,当研究者使用铁抑素-1(Fer-1)抑制细胞死亡后,显著改善了较高剂量二甲双胍处理后的I/R小鼠肾皮质的组织形态,减少了肾纤维化的情况;即Fer-1挽救了肾实质细胞,对肾脏以及肾实质细胞起到了保护作用。
与之类似,当给予小鼠为期9周的不同含铁量饮食,即高铁饮食(HID)、标准铁饮食(SID)或低铁饮食(LID)后诱导AKI发现,与SID喂养的相比,HID喂养的小鼠的死亡率显著增加,而LID的存活率则明显延长。
总结来说,在AKI中,体内铁水平下降缓解了二甲双胍引起的肾毒性。因此,铁死亡是“神药翻车”的重要一环,二甲双胍主要通过铁死亡途径介导肾实质细胞死亡,进一步加重肾毒性。
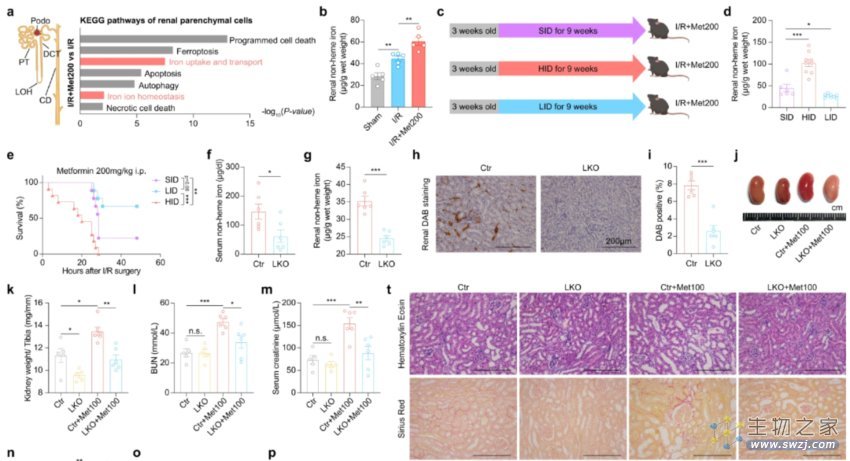
铁水平下降缓解了二甲双胍诱导的肾毒性
而整个过程的背后,是中性粒细胞和其特定的病理形式NETosis在作祟。scRNA-seq分析显示,二甲双胍干预引起了中性粒细胞的反应,导致循环中的中性粒细胞的数量显著增加,并在肾脏中被动员和扩张。
事实上,当大量中性粒细胞累积和浸润时,会形成一种特殊的病理形式NETosis,导致组织的损伤。举例来说,二甲双胍治疗AKI小鼠组中,在NETosis期间释放出的中性粒细胞特异性髓过氧化物酶(MPO)明显增加。
依此可见,在使用二甲双胍的基础上,中性粒细胞会渗入肾脏损伤部位,形成NETosis,从而驱动二甲双胍加重肾毒性的作用。
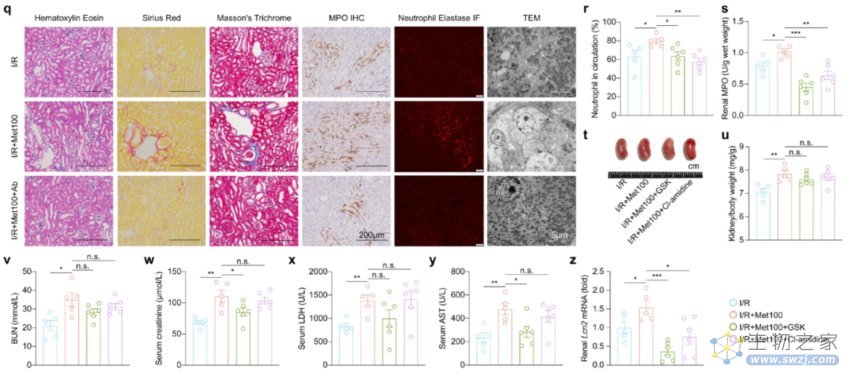
NETosis驱动二甲双胍的肾毒性
最后,还需要回答一个问题:循环中的中性粒细胞究竟是如何被“吸引”到肾脏的?
基于单细胞转录数据,研究者发现,编码NGAL蛋白的Lcn2基因,被确定为肾脏实质细胞中最显著上调的基因。那NGAL会不会是串起整个通路的关键一环?
于是,研究者敲除了小鼠肾脏中的内源性基因Lcn2后,发现该类小鼠中二甲双胍诱导的死亡被显著阻止了。血清生化指标也显示,在二甲双胍的作用下,基因编辑后的小鼠的肾脏损伤明显缓解,包括铁死亡的减轻、中性粒细胞浸润的减少以及NETosis数量下降。
与之相反,通过功能增益法,经过重组小鼠NGAL(rmNGAL)处理后,二甲双胍诱导的肾毒性被明显扩大。具体来说,rmNGAL干预增加了血液循环和肾脏中的中性粒细胞聚集,加重了肾实质细胞的形态变化。
通过化学元素的分析发现,三个二甲双胍分子和一个铁离子共同形成了复合物,在结合了NGAL后构成了更为稳定的NGAL-二甲双胍-Fe复合物形态。当给I/R小鼠模型注射该复合物后发现,它们能对中性粒细胞有明显的动员作用。
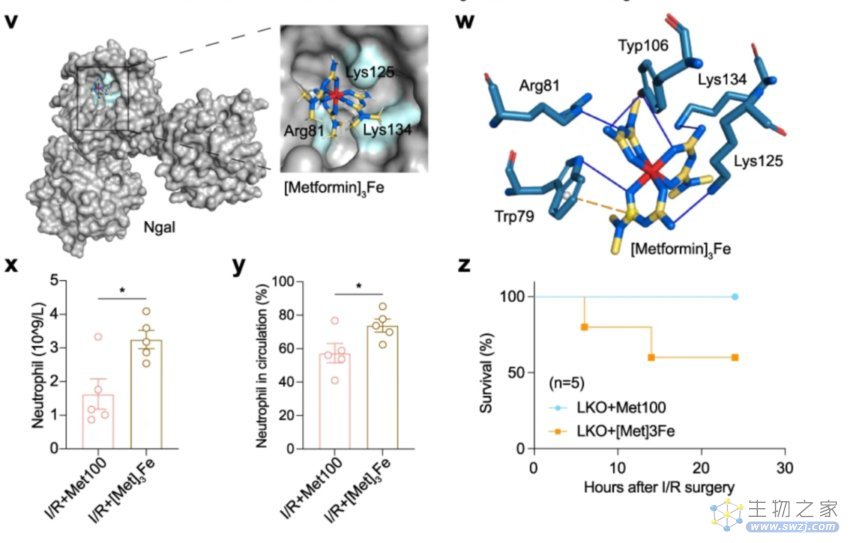
复合物形态
研究开展到这儿,二甲双胍诱发肾毒性的机制链路便已经很清晰了——二甲双胍不仅没有治疗AKI的作用,还会诱发铁死亡引起的程序性细胞死亡,从而加剧肾脏损伤程度。其中,中性粒细胞是驱动二甲双胍加重肾毒性的重要触发因素,即蛋白质NGAL与铁和二甲双胍能够形成复合物,推动中性粒细胞渗入肾脏,最终导致NETosis的发生,加重AKI。
研究者表示,这一结论也与先前的研究结果一致。在一项病例报告中,一名服用二甲双胍的2型糖尿病患者出现了明显的肾脏损害和全身器官酸中毒。同时,先前的多项队列研究和meta分析表明,高剂量二甲双胍可能会对糖尿病肾病患者产生不利影响,甚至加剧肾损伤。
因此,对于正在接受二甲双胍治疗的患者中,研究者建议定期监测全身NGAL和铁水平,以及肾脏功能情况。而对于那些非糖尿病患者,每天服用二甲双胍来延长寿命、改善体重和控制食欲的,在无法排除二甲双胍可能带来的肾损伤的情况下,还是要多加注意和监测。
总结来说,还是那句古话:“是药三分毒”,神药也逃不了。
参考资料:
Cai Z, Wu X, Song Z, Sun S, Su Y, Wang T, Cheng X, Yu Y, Yu C, Chen E, Chen W, Yu Y, Linkermann A, Min J, Wang F. Metformin potentiates nephrotoxicity by promoting NETosis in response to renal ferroptosis. Cell Discov. 2023 Oct 17;9(1):104. doi: 10.1038/s41421-023-00595-3. PMID: 37848438; PMCID: PMC10582023.































