11 月15 日晚,神州细胞发布公告,称其自主研发的 2 价和 4 价重组新冠病毒疫苗 III 期安全性和免疫原性临床试验与 mRNA 疫苗头对头比较的期中分析取得积极结果。值得注意的是,这一头对头疫苗为辉瑞 mRNA 疫苗。

一、神州细胞:2 款重组蛋白新冠疫苗,胜利在望
SCTV01C 和 SCTV01E 是神州细胞自主研发的新一代 2 价和 4 价变异株重组蛋白疫苗。
SCTV01C 的活性成分分别包含两种 WHO 认定的主要变异株阿尔法(Alpha)和贝塔(Beta)的重组 S 三聚体蛋白抗原,并采用比传统铝佐剂更能显著增强 Th1 细胞的水包油新型佐剂。SCTV01E 则是在 SCTV01C 的基础上新增了后续新出现的德尔塔和奥密克戎两个变异株 S 三聚体蛋白抗原构成的 4 价改良型疫苗升级版。
目前神州细胞 2 价疫苗 SCTV01C 和 4 价疫苗 SCTV01E 正在阿联酋进行 III 期安全性与免疫原性临床试验,研究共入组 1800 名健康成人志愿者,这些受试者之前已接种过新冠疫苗(灭活苗或 mRNA 苗)。
今年 10 月,神州细胞已披露了针对已接种灭活苗人群的期中分析结果。
NCT05323461 临床试验结果(已接种灭活苗人群)
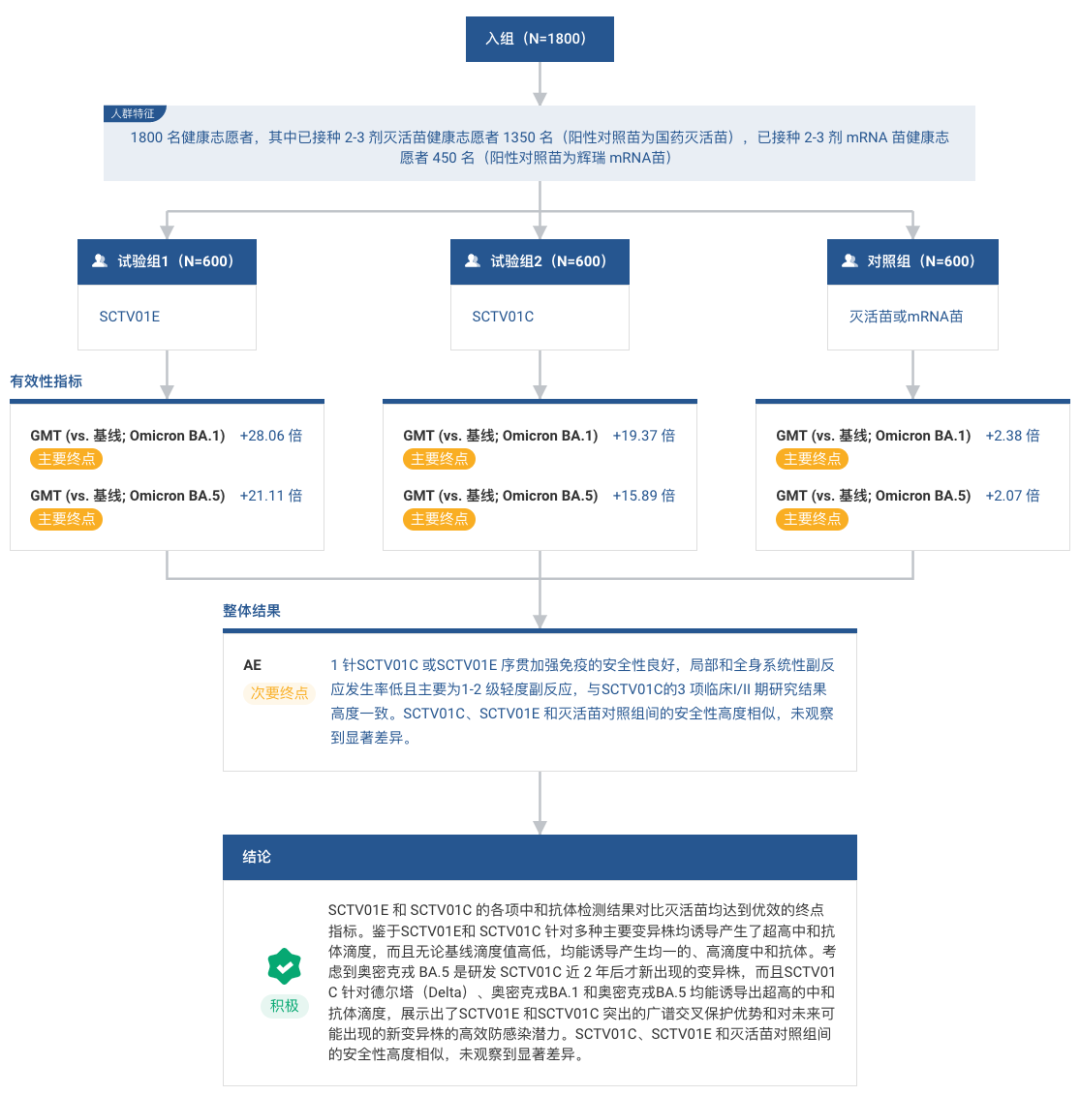
今日再下一城,神州细胞又披露了一个积极里程碑,且头对头辉瑞成功。
此次公布的数据是与 mRNA 新冠疫苗对照的结果数据。结果显示,针对 BA.1 和 BA.5 变异株,与辉瑞 mRNA 疫苗相比,神州细胞的 2 价疫苗 SCTV01C 达到非劣预设终点,而 4 价疫苗 SCTV01E 达到优效预设终点。
具体来看:
针对 BA.1,加强免疫后 28 天后,在 BA.1 基线滴度值不高于 80 的易感人群亚组中,mRNA 苗、2 价苗和 4 价苗诱导的真病毒中和抗体滴度值较基线提高 14.1 vs 14.8 vs 24.8 倍。
针对 BA.5,加强免疫后 28 天后,在 BA.5 基线滴度值不高于 80 的易感人群亚组中,mRNA 苗、2 价苗和 4 价苗诱导的真病毒中和抗体滴度值较基线提高 13.1 vs 32 vs 22.6 倍。
与辉瑞 mRNA 疫苗相比:
针对奥密克戎 BA.1 的真病毒中和抗体,SCTV01C 对比辉瑞 mRNA 苗的 LS GMR(最小二乘几何均值比)为 1.04(95% CI:0.87,1.24),达到了预设的非劣终点(WHO 的非劣边界下限标准为 0.67);SCTV01E 对比辉瑞 mRNA 苗的 LS GMR 为 1.55(95% CI: 1.30,1.85),P 值<0.0001,达到了预设的优效终点。
针对奥密克戎 BA.5 的真病毒中和抗体,SCTV01C 对比辉瑞 mRNA 苗的 LS GMR 为 0.92(95% CI: 0.77,1.10),达到了预设的非劣终点;SCTV01E 对辉瑞 mRNA 苗的 LS GMR 为 1.28(95% CI: 1.07,1.54),P 值为 0.0069,达到了预设的优效终点。
二、重组蛋白新冠疫苗赛道,三叶草生物或将拔得头筹?
说到重组蛋白疫苗,三叶草生物重组蛋白新冠候选疫苗 SCB-2019 近期备受市场与业内人士的关注。
SCB-2019(CpG 1018/铝佐剂)是三叶草生物利用 Trimer-Tag™开发的 SCB-2019 抗原,联合两种佐剂 Dynavax CpG 1018 佐剂和氢氧化铝 (铝佐剂) 组成的一款重组蛋白新冠疫苗。
此前,三叶草披露的 II/III 期临床试验显示,SCB-2019 针对奥密克戎 BA.5 强劲的中和反应。
在成年人群 (≥ 18 岁) 中开展的试验显示,接种 SCB-2019 5 个月后,SCB-2019 预防重度新冠肺炎的保护效力为 100%,预防由任何毒株引起的需住院的新冠肺炎的保护效力为 95%。且在青少年(12-17 岁)中也可诱导强劲的免疫反应并具有良好的安全性和免疫原性。
今年 8 月,三叶草生物公布了一项来自全球 II/III 期临床试验新结果。数据表明,相较于安慰剂接种者,接种 SCB-2019 的人将新冠感染传染给居住于同一家庭中另一人的可能性降低了 84%。这一数据表明,接种 SCB-2019 可显著减少新冠在家庭接触者中的传播,有望在社区内助力控制新冠的传播。
不止于此,三叶草生物还评估了 SCB-2019 作为通用新冠加强针候选疫苗的疗效,今年 9 月披露的 III 期临床试验的积极数据结果,让更多业内人士对该产品充满期待:
结果显示,针对 BA.5 变异株亚型和奥密克戎其他变异株亚型(BA.1 和 BA.2),在既往接种两剂灭活疫苗的受试者中,接种 SCB-2019 作为异源第三剂相较于第三剂接种灭活疫苗诱导了高 5 至 6 倍的中和抗体水平;针对新冠原始毒株的免疫反应高 12 倍。
目前三叶草生物正在开展 SCB-2019 在多个国家的注册申请递交工作。计划于今年完成对中国国家药品监督管理局、欧洲药品管理局和世界卫生组织的注册申请递交计划。
三、沃森、艾博、蓝鹊…内卷新冠 mRNA 疫苗赛道
除重组蛋白新冠疫苗领域外,mRNA 新冠疫苗赛道可以说竞争比较激烈了。
在该赛道,国际巨头非辉瑞莫属,其新冠疫苗 Comirnaty 2021 年产量超 30 亿剂次、销售额高达 367.81 亿美元。今年 Q3, Comirnaty 的全球收入为 44.02 亿美元,虽然同比下降了,但辉瑞仍旧上调了 Comirnaty 的 2022 年营收指引,从 320 亿美元上升至 340 亿美元。其中也能看出辉瑞对 Comirnaty 的信心。
曾有分析师指出,国产 mRNA 新冠疫苗市场商业价值巨大。即便当前尚未有国产 mRNA 新冠疫苗在国内获批上市,但已有多家国产企业在积极推进在研产品的开发进度,且已取得一定结果。
1、沃森生物/军科院/艾博生物:Awcorna
今年 9 月,沃森生物/军科院/艾博生物合作研发的新冠 mRNA 疫苗(沃艾可新/Awcorna/ARCoVaX)获得印度尼西亚紧急使用授权(EUA),成为国产自主研发的首个获批海外上市的新冠 mRNA 疫苗,用于 18 岁及以上人群基础免疫或加强免疫。
AWcorna 与现在国外上市的两个 mRNA 疫苗不同,只用了刺突蛋白的一段—— RBD 区域,而非全长刺突蛋白。
今年 6 月,有关 AWcorna 一项小型临床试验(注册号:ChiCTR2100053701)结果在 Cell Research 期刊上发表。
该研究评估了 AWcorna 作为第三针异源增强的安全性和免疫原性。研究共入组了 300 名成人受试者,所有符合条件的受试者均接种了 2 针灭活疫苗 CoronaVac 或 BBIBP-CorV。在接种后 6 个月,所有受试者被随机分配到 AWcorna(n = 200; 异源)或 CoronaVac(n = 100; 同源)加强组。
结果显示,针对原始毒株、Delta 和 Omicron 变异株,AWcorna 组在中和抗体 GMT 方面都优于灭活疫苗,两组均未发现严重不良事件,总体安全可控。
针对原始毒株、Delta 变异毒株的中和抗体 GMT
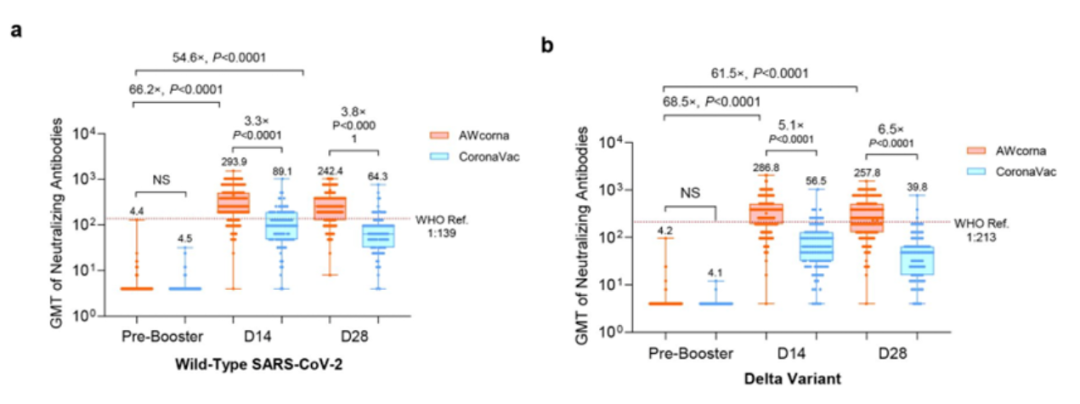
对于 Delta 突变株,AWcorna 加强组接种第 14 天和 28 天的 GMT 是 CoronaVac 加强组接种的 5.1 和 6.5 倍。
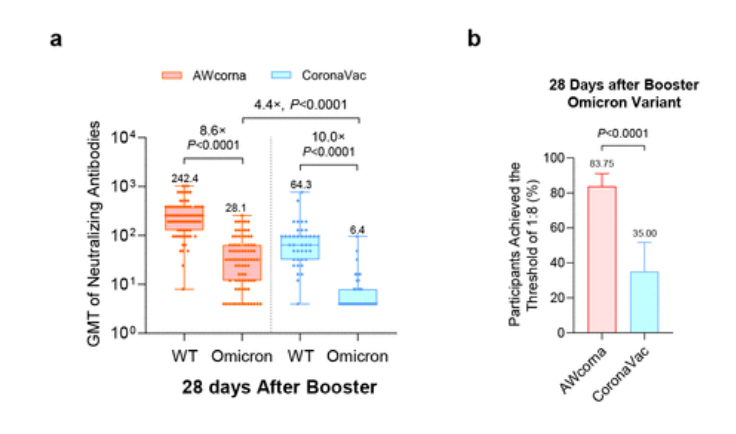
针对 Omicron 突变株,AWcorna 加强组是 CoronaVac 加强组的四倍之多。此外,AWcorna 加强组的受试人员中,83.75% 的参与者达到了针对 Omicron 的中和抗体滴度的 1:8 阈值,而 CoronaVac 加强组只有 35%。
针对 Omicron 毒株的中和抗体的 GMT
据沃森生物昨日新闻稿,AWcorna 目前正在开展三期临床试验,且已处于最后阶段。
2、沃森生物与复旦大学、蓝鹊生物:新型冠状病毒变异株 mRNA 疫苗(S 蛋白嵌合体)
除 Awcorna 外,沃森在研的另一款新冠 mRNA 疫苗也已进入 III 期临床阶段。
这是一款沃森生物与复旦大学、蓝鹊生物共同研发的新型冠状病毒变异株 mRNA 疫苗(S 蛋白嵌合体)(代号:RQ3013),针对新冠病毒变异株设计开发,编码几乎全长 S 蛋白嵌合体的创新型广谱新冠 mRNA 疫苗。
相较于辉瑞/ BioNTech 的 BNT162b2 和 Moderna 的 mRNA-1273 采用的 S2P 结构,RQ3013 没有引入脯氨酸替代,但在弗林切割点(Furin cleavage)进行了改造,使产生的 S 蛋白不受到蛋白酶介导的蛋白分解作用。
RQ3013 mRNA疫苗设计图示(a),表达抗原的结构表征(b,c)
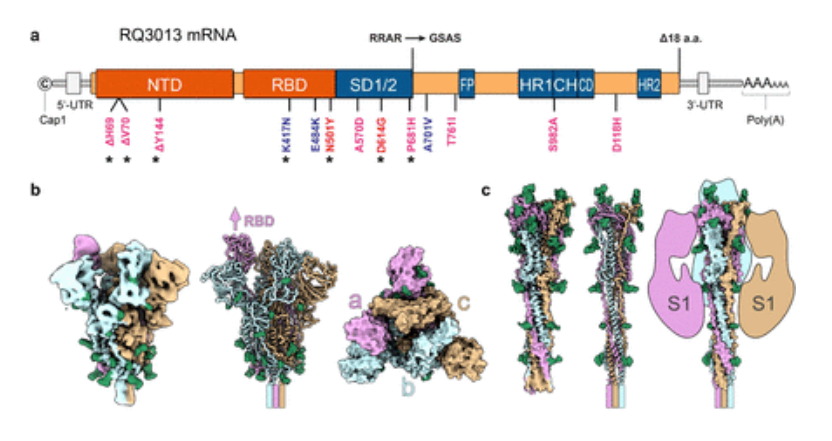
临床前研究表明,该疫苗具有良好的安全性和保护效果,对包括 Omicron 株在内的主要新型冠状病毒 VOCs 均具有一定的交叉中和能力。
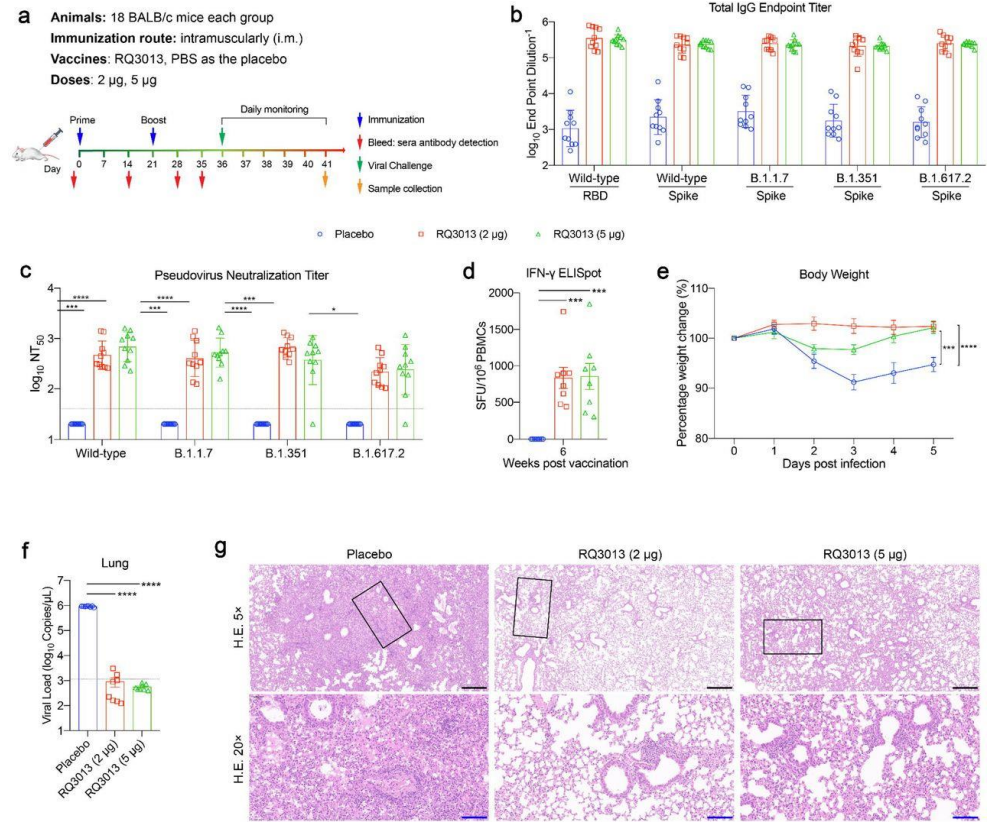
RQ3013 在 BALB/c 小鼠中显示对新冠的广谱中和能力
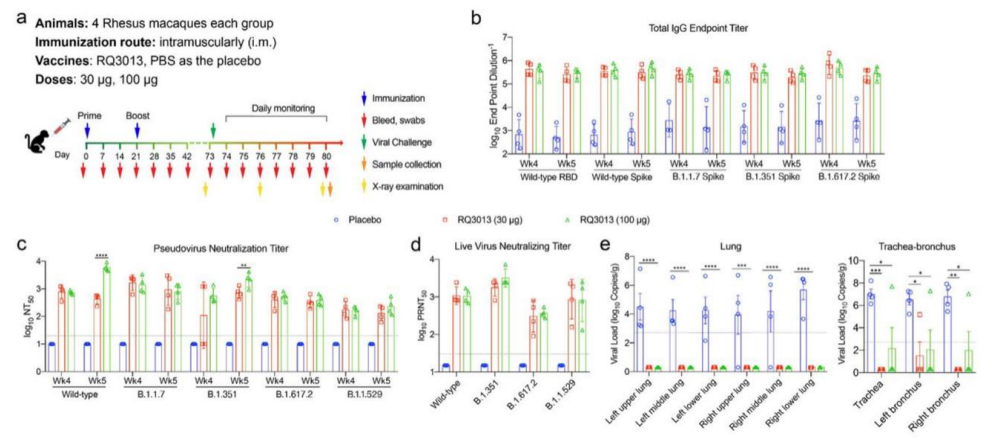
RQ3013 在恒河猴中显示对新冠的广谱中和能力
RQ3013 的临床开发速度也很迅速。今年 9 月,RQ3013 获 NMPA 批准进入临床研究,成为首个进入临床的 mRNA 嵌合体疫苗。
11 月初,RQ3013 获得 Ⅲb 期临床试验伦理审查批件,针对已完成 3 剂新冠灭活疫苗接种的 18 岁及以上人群。11 月 14 日,针对投资者关于 RQ3013 临床试验进展的提问,沃森生物表示当前正在开展 RQ3013 IIIb 期临床试验的入组工作。
昨日,沃森生物发布公告,称 RQ3013 已获得 III a 期临床试验伦理快速审查批件。
在新冠 mRNA 疫苗领域,国产企业斯微生物、康希诺、石药集团等公司均有所布局,且实力不可小觑。
值得一提的是,康希诺除新冠 mRNA 疫苗外还开发了吸入用新冠疫苗,并于今年 9 月获批作为加强针纳入紧急使用,区别于传统疫苗,其不再通过上臂针刺,而是使用定制化的机器设备将疫苗制剂雾化,接种者通过口腔进行吸入。































