胶质母细胞瘤(GBM)是最具侵袭性原发性脑肿瘤(之一),具有死亡率高、生存期短、预后差、复发率高的特点。在过去的几十年里,针对胶质母细胞瘤(GBM)的治疗效果几乎没有取得什么突破性进展,患者5年生存率仅为5%左右。其中部分原因是其具有肿瘤抑制和逃逸人体自然抗癌免疫反应的能力。
以免疫检查点抑制剂为代表的癌症免疫疗法,可以重新激活免疫系统来对抗癌症。但这种治疗方法若要有效,肿瘤中必须存在杀伤T细胞。不幸的是,脑肿瘤中的血管功能失调并充当屏障,阻止杀伤性T细胞到达肿瘤中。因此,这种对多种癌症有效的癌症免疫疗法对脑肿瘤却无效。
近日,乌普萨拉大学的研究人员在 Cancer Cell 期刊发表了题为:Tailoring vascular phenotype through AAV therapy promotes anti-tumor immunity in glioma 的研究论文。
该研究开发出一种方法来帮助杀伤性T细胞到达脑肿瘤并对抗癌细胞。他们使用一种可特异性感染大脑血管的腺相关病毒(AAV)载体,使它们表达一种名为LIGHT的因子。这改变了肿瘤血管功能,增加了它们将T细胞从血液输送到肿瘤组织的能力,从而改善对免疫疗法耐药的胶质母细胞的治疗效果。

胶质母细胞瘤是一种侵袭性脑肿瘤,对癌症免疫治疗有很大的抵抗力。这与免疫抑制和功能失调的肿瘤血管系统有关,其阻碍了T细胞的浸润。
肿瘤坏死因子配体超家族成员14(TNFSF14),是TNF超家族的分泌蛋白,也称为LIGHT。而LIGHT可诱导高内皮微静脉(HEV)和三级淋巴样结构(TLS),这表明其治疗性表达可促进T细胞募集。
在这项最新研究中,研究团队使用脑内皮细胞靶向的腺相关病毒(AAV)载体在胶质瘤脉管系统中表达LIGHT(AAV-LIGHT)。
使用AAV-LIGHT作为胶质母细胞瘤的治疗方法时,肿瘤血管的形状和功能发生了改变。AAV载体诱导血管中产生LIGHT,从而调整血管功能,将杀伤性T细胞招募到肿瘤中。这也在血管周围创造了一个有利环境,支持杀伤性T细胞的功能。
AAV-LIGHT还诱导与脑肿瘤相关的称为三级淋巴结构(TLS)的免疫细胞聚集体的形成。这种结构类似于淋巴结,它们在肿瘤中的存在与对癌症免疫治疗的敏感性增加有关。
研究团队表示,使用AAV-LIGHT疗法时,形成了三级淋巴结构(TLS),杀伤性T细胞可以被激活来对抗TLS中的肿瘤细胞。AAV-LIGHT疗法延长了胶质母细胞瘤小鼠模型的生存期,部分小鼠甚至被治愈了,这非常令人兴奋。
研究团队还发现,AAV-LIGHT疗法改变了TLS的组成,使其包含大量的T细胞。这意味着我们可以利用该疗法来操纵TLS的组成。这是一个全新的认知,也可以作为改变TLS结构功能的新工具。
此外,AAV-LIGHT疗法还促进了一种特殊的杀伤性T细胞群——干细胞样T细胞(stem-like T cells),它们既位于TLS内,也位于肿瘤血管周围形成的特殊生态位中。AAV-LIGHT疗法增加了干细胞样T细胞的存在,而它们可以增强免疫治疗效果。
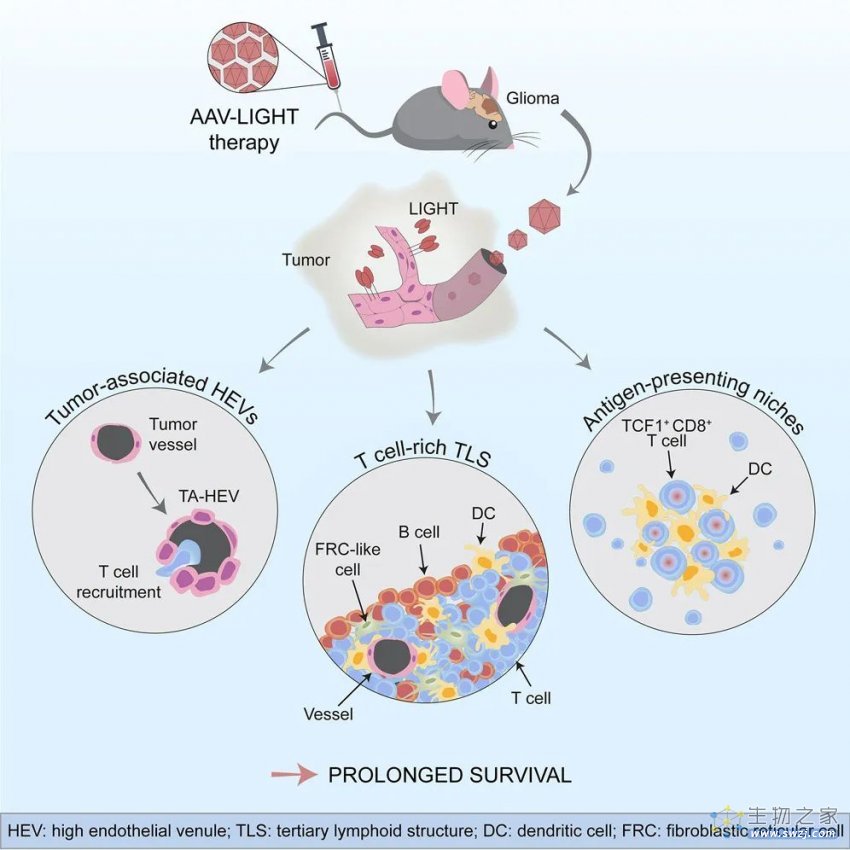
总的来说,这项研究表明,系统性AAV-LIGHT治疗可诱导肿瘤相关的高内皮微静脉(HEV)和富含T细胞的三级淋巴样结构(TLS),延长抗PD-1单抗治疗耐药的胶质母细胞瘤小鼠模型的生存期。AAV-LIGHT治疗还可减少T细胞耗竭,促进TCF1+CD8+干细胞样T细胞,这些细胞位于TLS和肿瘤内抗原呈递生态位中。AAV-LIGHT治疗后肿瘤消退与肿瘤特异性细胞毒性/记忆T细胞反应相关。这提示了我们,通过血管靶向表达LIGHT来改变血管表型,可以促进有效的抗肿瘤T细胞反应并延长胶质瘤的生存期。这些发现对其他免疫治疗耐药癌症的治疗具有更广泛的意义。
研究团队表示,希望进一步开发这种新疗法,以确定AAV-LIGHT是否可以用于人类胶质母细胞瘤患者。在开始临床研究之前,还需要进一步发展病毒载体,但结果非常有希望。
论文链接:https://doi.org/10.1016/j.ccell.2023.04.010































