三阴性乳腺癌(Triple negative breast cancer, TNBC)由于缺乏特异性分子标记物,目前其临床的一线辅助治疗方案仍以化疗为主,缺乏特异性的治疗手段1,明确三阴性乳腺癌转移与耐药的潜在机制并针对性开发特异性靶向药物,具有较大的临床价值。近年来的研究表明,乳腺肿瘤内部存在一小部分致癌能力强,分化程度低的细胞,因其具有干细胞的自我更新及多向分化特性,被称为乳腺癌肿瘤干细胞(Breast cancer stem cells, BCSCs)2-4,被认为是导致乳腺癌转移和耐药的关键因素。其中乙醛脱氢酶1(Aldehyde dehydrogenases 1, ALDH1)活性高的细胞亚群被认为具备肿瘤干细胞的特征,ALDH+细胞更容易产生细胞克隆集落,具备更大的致瘤潜能和耐药性,是导致乳腺癌辅助治疗耐药的重要因素2,5。然而,调控三阴性乳腺癌中ALDH+细胞的潜在机制尚不明确,识别ALDH+细胞的上游调控因子并抑制ALDH+细胞的干性可能成为三阴性乳腺癌辅助治疗的一种全新治疗策略。
2023年5月5日,中国医科大学附属盛京医院刘彩刚教授团队在Nature Communications在线发表题为KK-LC-1 as a therapeutic target to eliminate ALDH+ stem cells in triple negative breast cancer的研究论文。该研究综合运用mRNA-seq、散点质谱技术与生物膜干涉技术,发现了调控三阴性乳腺癌中ALDH+细胞干性的潜在新机制并筛选得到了具备较好生物学活性的小分子化合物Z839878730,为三阴性乳腺癌的分子机制探究及治疗策略革新提供了全新的视角。

BCSCs可来自于正常乳腺干细胞的恶变或其所分化成的子代细胞的逆转,具有自我更新、多向分化、多药耐药以及维持恶性生长的特性。现有的乳腺癌治疗思路主要是针对普通的癌细胞,但对于引发癌症的肿瘤干细胞办法不多,在辅助治疗过后,BCSCs往往仍会残存,进而介导了乳腺癌的耐药,甚至远期复发及转移。因此,专门针对BCSCs的治疗可能成为根治乳腺癌细胞,逆转耐药,延缓复发和转移的重要方式。刘彩刚教授团队多年来致力于BCSCs 相关的临床与基础研究工作。在针对BCSCs的研究中,刘彩刚教授课题组发现了CD44lowCD24low非干细胞可以自发去分化为CD44highCD24low干细胞的现象并深入揭示了其调控机制6;还发现了利用小分子化合物LFS-1107靶向抑制CRM1蛋白可以有效地削弱三阴性乳腺癌中CD44highCD24low肿瘤干细胞的干性7。
在本研究中,研究团队通过对分析多西他赛耐药细胞中的高表达基因与三阴性乳腺癌中的高表达基因,发现了KK-LC-1在三阴性乳腺癌中耐药性较强的ALDH+细胞中显著高表达(图一)。在此基础上,研究团队在三阴性乳腺癌细胞中敲除/敲低KK-LC-1,发现KK-LC-1的沉默或缺失可以显著降低三阴性乳腺癌中的ALDH+细胞比例,削弱ALDH+细胞的成球能力,自我更新能力与致瘤性。
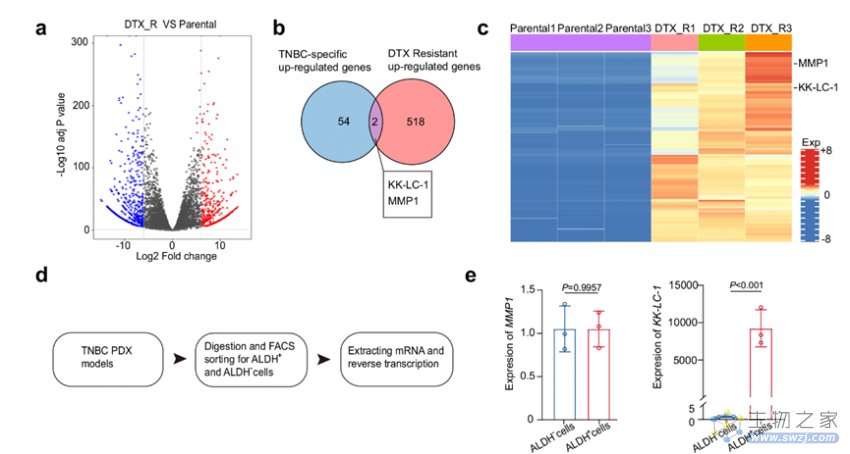
图一:KK-LC-1在三阴性乳腺癌多西他赛耐药株及ALDH+细胞中显著高表达
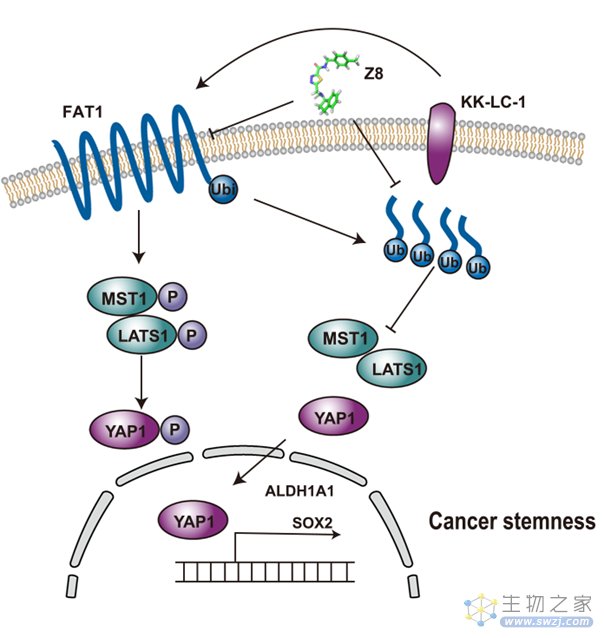
研究团队进一步利用mRNA-seq技术对KK-LC-1-/- MDA-MB-231细胞与KK-LC-1+/+ MDA-MB-231细胞进行通路富集分析,发现Hippo信号通路是改变最显著的干性相关信号通路。利用散点质谱技术发现了KK-LC-1的下游潜在互作蛋白FAT1(图二)。既往研究报道,在人体中,FAT1可以在激素受体阳性乳腺癌中调控Hippo通路8;在小鼠和人类鳞状细胞癌中,FAT1的缺失可以促进肿瘤发生、进展增加其侵袭性、干性和转移能力9。因而研究组猜想FAT1可能是KK-LC-1介导三阴性乳腺癌细胞干性的关键下游蛋白。利用Co-IP实验,免疫印迹实验及临床样本的免疫组化实验发现了KK-LC-1可以与FAT1结合且二者表达呈负相关。机制上看,KK-LC-1可以增加FAT1的泛素化修饰并促进其降解,从而抑制Hippo信号通路的激活。当Hippo信号通路被抑制后,YAP1入核增加,促进了维持ALDH+细胞干性的关键同工酶ALDH1A1的转录与表达。
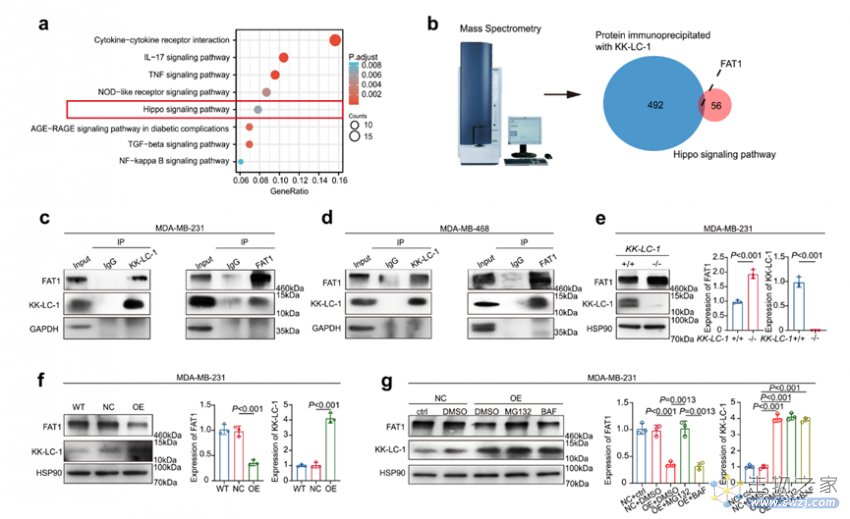
图二:散点质谱发现KK-LC-1可以与FAT1相结合,且二者表达呈负相关
为进一步探究该机制对抑制三阴性乳腺癌中ALDH+细胞的有效性,研究团队利用自研小分子化合物结构模拟筛选工具FIPSDock10对KK-LC-1与FAT1的结合位面进行计算机结构模拟,虚拟口袋筛选,从MCE天然化合物库中模拟筛选了近70000个小分子化合物,最终得到了145个具备潜在阻断二者结合能力的小分子化合物,并通过生物膜干涉实验(Biolayer interferometry, BLI)进行验证,发现了最优小分子化合物Z839878730(Z8)(图三)。
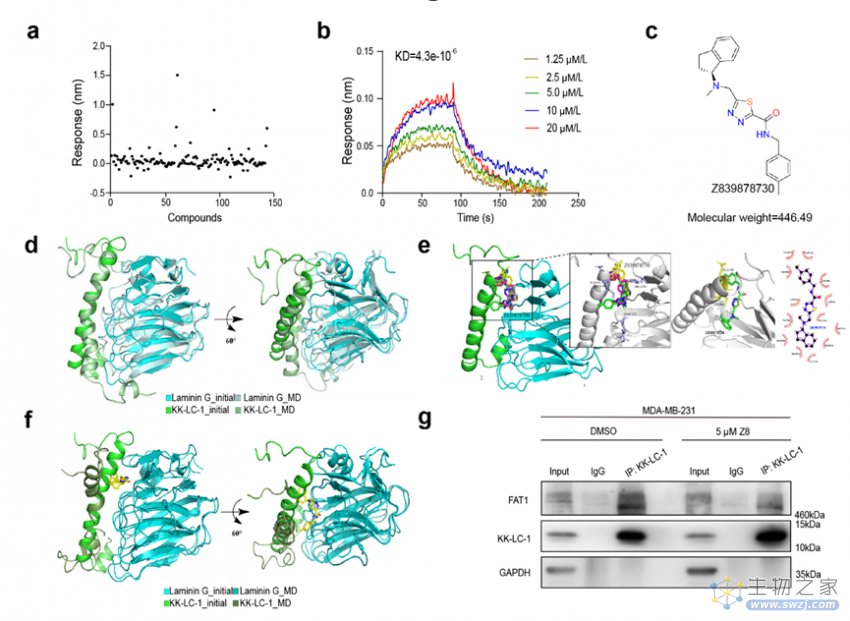
图三:利用计算机虚拟筛选与生物膜干涉技术发现Z839878730可以有效阻断KK-LC-1与FAT1的结合
通过Co-IP与免疫印迹实验,研究团队发现Z8可以阻断KK-LC-1与FAT1的结合,并浓度依赖性地增加FAT1的表达从而激活Hippo信号通路。研究团队运用一系列体内外实验,发现Z8同样具备较好的对三阴性乳腺癌中ALDH+细胞的抑制作用,在裸鼠荷瘤药敏实验与临床样本来源的异种移植模型(Patient derived xenograft,PDX)上都展现出了良好的抗肿瘤效果。
综上,本研究创新性地提出了在三阴性乳腺癌中KK-LC-1对ALDH+细胞的干性调控作用,阐明了KK-LC-1通过FAT1-Hippo-YAP1-ALDH1A1进行信号传递的分子机制,并筛选得到了具备较好生物学活性的靶向小分子化合物Z8,为三阴性乳腺癌的治疗提供了新的靶标与方向。
机制示意图
参考文献:
1 Won, K. A. & Spruck, C. Triplenegative breast cancer therapy: Current and future perspectives (Review). Int J Oncol 57, 1245-1261, doi:10.3892/ijo.2020.5135 (2020).
2 Liu, S. et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports 2, 78-91, doi:10.1016/j.stemcr.2013.11.009 (2014).
3 Nguyen, L. V., Vanner, R., Dirks, P. & Eaves, C. J. Cancer stem cells: an evolving concept. Nat Rev Cancer 12, 133-143, doi:10.1038/nrc3184 (2012).
4 Zhang, R., Tu, J. & Liu, S. Novel molecular regulators of breast cancer stem cell plasticity and heterogeneity. Semin Cancer Biol, doi:10.1016/j.semcancer.2021.03.008 (2021).
5 Ginestier, C. et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell stem cell 1, 555-567, doi:10.1016/j.stem.2007.08.014 (2007).
6 Qiao, X. et al. Association of human breast cancer CD44(-)/CD24(-) cells with delayed distant metastasis. Elife 10, doi:10.7554/eLife.65418 (2021).
7 Liu, C. et al. A highly potent small-molecule antagonist of exportin-1 selectively eliminates CD44(+)CD24(-) enriched breast cancer stem-like cells. Drug Resist Updat 66, 100903, doi:10.1016/j.drup.2022.100903 (2023).
8 Li, Z. et al. Loss of the FAT1 Tumor Suppressor Promotes Resistance to CDK4/6 Inhibitors via the Hippo Pathway. Cancer Cell 34, 893-905 e898, doi:10.1016/j.ccell.2018.11.006 (2018).
9 Pastushenko, I. et al. Fat1 deletion promotes hybrid EMT state, tumour stemness and metastasis. Nature 589, 448-455, doi:10.1038/s41586-020-03046-1 (2021).
10 Liu, Y. et al. FIPSDock: a new molecular docking technique driven by fully informed swarm optimization algorithm. J Comput Chem 34, 67-75, doi:10.1002/jcc.23108 (2013).































