这项研究首次揭示了铁死亡和相分离之间的联系。Conrad解释说:“因此,我们的研究将为进一步开发某些疾病的创新治疗方法提供一个很好的模型,包括癌症,因为其中铁死亡/相分离起着重要作用。”
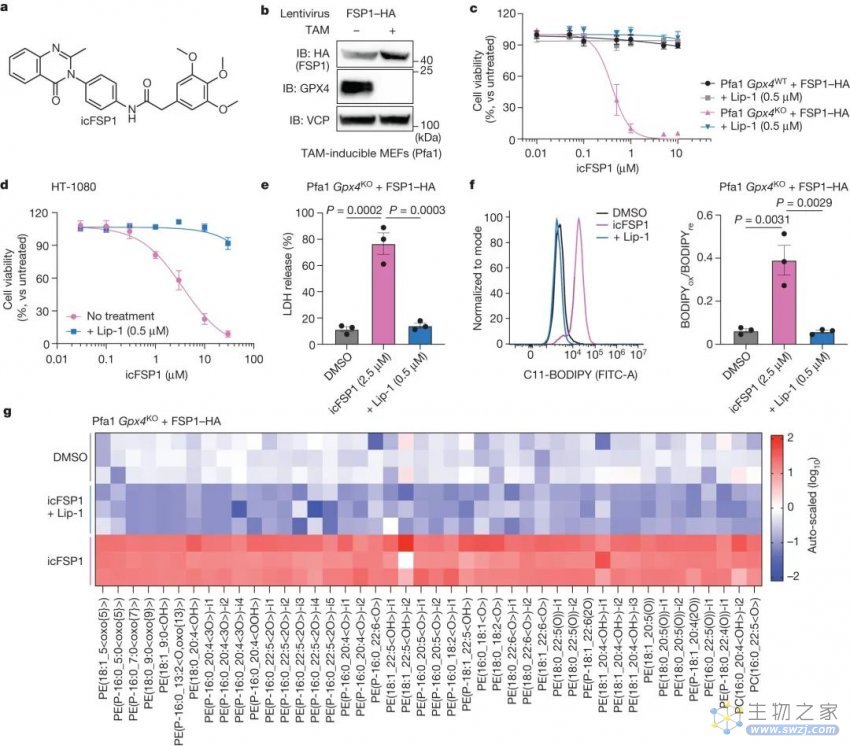
icFSP1与GPX4抑制协同诱导铁死亡,图片来自论文
由慕尼黑亥姆霍兹中心的Marcus Conrad博士领导的一个研究小组发现了一种新型的抗癌药物,称为icFSP1,它能使癌细胞对铁死亡作用敏感。
铁死亡(ferroptosis)是近年发现的一种新型细胞死亡方式,其特征是脂质过氧化物和活性氧(ROS)的过量蓄积。由于该过程依赖铁,所以被称为铁死亡。而铁死亡抑制蛋白1 (ferroptosis suppressor protein 1,FSP1) 将细胞膜上的泛醌转化为其还原型——泛醇,泛醇能抑制过氧化反应并阻止铁死亡。尽管FSP1已被认为是癌症治疗的一个有吸引力的药物靶点,但一直缺乏体内有效的FSP1抑制剂。为此,研究小组仔细评估了大约一万种小分子化合物,并确定icFSP1是一种新的体内有效药物。重要的是,该团队揭示了icFSP1的作用机制:它基于触发FSP1的相分离,这是一种类似于油和水分离的细胞物理现象。事实上,icFSP1在体内强烈抑制肿瘤生长,在肿瘤组织中有明显的FSP1凝聚物,从而提出了通过促进FSP1相分离和铁死亡来对抗肿瘤的新概念。
研究结果发表在《自然》杂志上。
icFSP1是一种体内适用的FSP1抑制剂
化疗耐药或肿瘤转移是肿瘤的重要临床问题。值得注意的是,在去分化或代谢重组过程中,某些恶性癌细胞获得了对铁死亡的内源性易感性。因此,靶向铁死亡的治疗已显示出巨大的希望作为癌症治疗的途径。2019年,亥姆霍兹代谢与细胞死亡研究所所长Marcus Conrad领导的一组研究人员已经确定了第一个FSP1特异性抑制剂,称为iFSP1。Conrad解释说:“然而,这种化合物不适合在体内使用,高浓度时表现出脱靶效应。”为了鉴定体内针对FSP1的活性铁死亡诱导剂,研究小组在细胞中进行了筛选活动,随后进行了DMPK(“药物代谢和药代动力学”)验证研究。这些努力最终导致icFSP1被鉴定为一类新的化合物,可以使许多人类癌细胞对铁死亡敏感,并在体内减弱肿瘤的生长。
icFSP1触发FSP1的相分离
通过详细研究icFSP1的潜在作用机制(MoA),研究小组进一步表明,icFSP1并不直接抑制FSP1酶的活性,而是在一个被称为相分离的过程中触发FSP1的亚细胞重新定位。这些结果与第一种FSP1抑制剂iFSP1的MoA形成对比。该研究的主要作者Toshitaka Nakamura进一步解释说,"icFSP1诱导的FSP1凝聚需要不同的结构成分和N端肉豆蔻化",这一点通过使用重组的FSP1蛋白以及不同的细胞系和肿瘤样本得到了证明。
突破性进展:将铁死亡和相分离联系起来
铁死亡在许多领域引起了极大的兴趣,包括癌症、神经退行性疾病和缺血/再灌注损伤,类似于相分离的过程,这是一种基本的物理现象,是与多种疾病相关的信号转导和基础生物学的基础。
这项研究首次揭示了铁死亡和相分离之间的联系。Conrad解释说:“因此,我们的研究将为进一步开发某些疾病的创新治疗方法提供一个很好的模型,包括癌症,其中铁死亡/相分离起着重要作用。”这为未来提供了一个充满希望的前景。
参考文献
Phase separation of FSP1 promotes ferroptosis































