有这样一种“神药”,全世界约有1.5亿人在服用它,具有多种神奇功效,但药价并不昂贵——它就是二甲双胍。
二甲双胍是目前治疗2型糖尿病的一线药物,临床应用已超过60年。因其良好的降糖效果并配合降低体重、较好的安全性以及心血管保护等特点,二甲双胍被多个指南推荐为2型糖尿病控制高血糖的基础治疗药物,在临床上有着“无可撼动”的地位。
随着日渐丰富的临床应用证据,《二甲双胍临床应用专家共识(2023年版)》于今年6月2日重磅发布。其中特别提到了,二甲双胍之所以能“封神”,很大一部分原因是该药还在降糖外的领域“大放异彩”,比如:减重、心血管保护、降血脂、抗肿瘤、改善认知功能等等。
今天,小编带大家一起来盘一盘——二甲双胍“神”在何处?

二甲双胍与认知功能改善
《二甲双胍临床应用专家共识(2023年版)》中提到了二甲双胍对认知功能的影响——先前研究中发现,使用二甲双胍或可降低老年2型糖尿病患者的认知功能减退以及帕金森病的患病风险。
而近日,同济大学团队在Microbiome上发表最新研究揭示了“二甲双胍改善大脑认知功能”的深层机制。具体来说,在二甲双胍的介导下,肠道微生物群中的有益菌AKK菌在其中富集,通过减少促炎细胞因子IL-6来调节宿主体内与炎症相关的通路,从而改善了老年小鼠的认知功能。

研究者发现,接受二甲双胍治疗的小鼠在Morris水迷宫中有着有着更好的表现,这意味着在二甲双胍的治疗下,小鼠的空间学习和记忆功能得到了显著的改善。
同样,新物体识别测试也出现了类似的结果——治疗组小鼠接触新事物的次数显著增加,即二甲双胍提高了小鼠的工作记忆能力。
很明显,二甲双胍治疗的的确确改善了老年小鼠的认知功能。
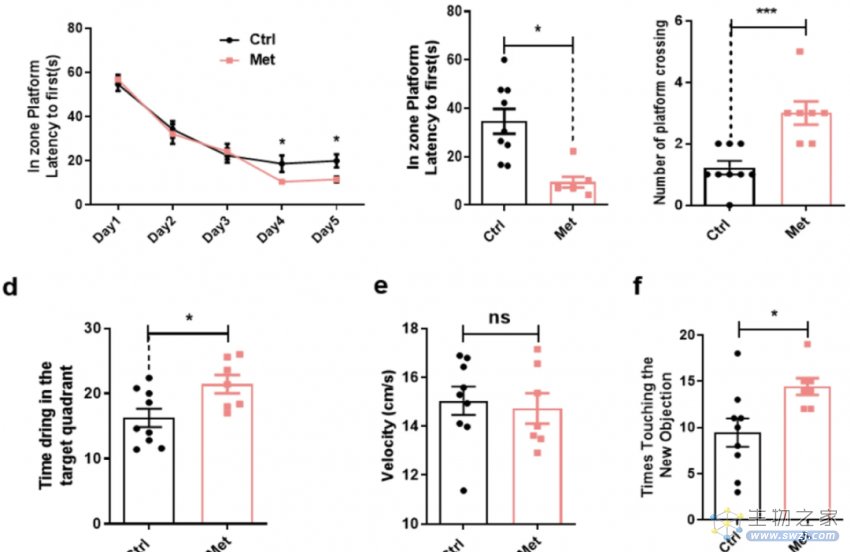
二甲双胍治疗下老年小鼠认知功能的变化
进一步,研究者检测了二甲双胍对肠道微生物群结构的影响,并确定其在“二甲双胍影响认知功能”中是充分必要条件。
在对接受二甲双胍治疗1个月的小鼠粪便样本进行了元基因组分析后发现,小鼠的肠道微生物群结构与对照组“大相径庭”。
在物种层面,观察到A. muciniphila, Lactobacillus salivarius, Lactobacillus reuteri和Parabacteroides distasonis的相对丰度急剧增加,而这些菌群往往在年轻小鼠肠道中的丰度更高。换言之,二甲双胍能够重塑老年小鼠的肠道微生物群结构,使其更接近于年轻表型。
为了确定“肠道微生物”在药物发挥作用中的不可或缺性,研究者使用抗生素干扰了小鼠肠道微生物群的正常变化。结果显示,在Morris水迷宫和新物体识别测试中,这些小鼠的成绩与对照组几乎没有差异。
可见,抗生素对肠道菌群的影响,阻止了二甲双胍诱导的空间和工作记忆功能的改善;所以,“神药”改善老年小鼠认知功能的过程,离不开肠道微生物群!
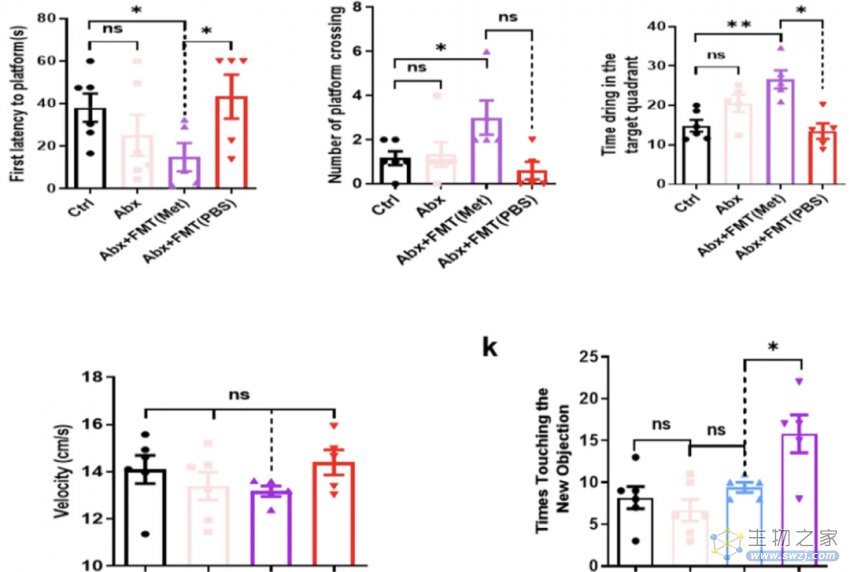
肠道微生物群对二甲双胍影响认知功能是必要和充分的
当然,在众多变化的肠道菌群中,找到“扭转乾坤”作用的一员大将并不容易。基于此前的研究,研究者将目光投向了A. muciniphila(AKK菌)。
在实验的30天内,研究者每隔1天给小鼠服用109cfu的AKK菌,提高其体内的AKK菌丰度。果不其然,在AKK菌的治疗下,小鼠在两个记忆测试中的表现明显更好,可见二甲双胍治疗后富集的AKK菌能有效改善认知功能。
不仅如此,转录组分析显示,AKK菌下调了外周血中的促炎途径,并降低了血浆中的促炎细胞因子水平;甚至还能抑制大脑海马组织的炎症通路,促进神经活动,从而改善老年小鼠的认知能力。
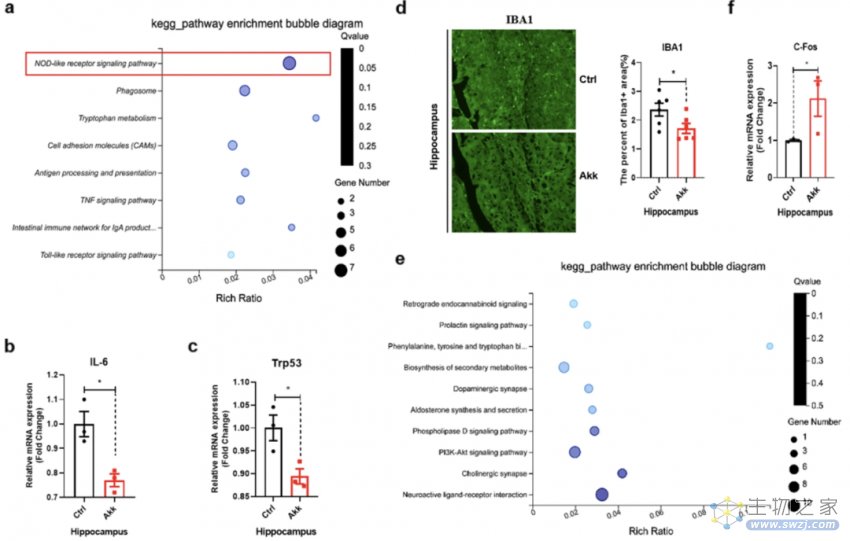
AKK菌对大脑海马组织的影响
研究开展到这儿,一切机制便“水落石出”了。总结来说,二甲双胍能改变肠道菌群,尤其是AKK菌的增殖,抑制了促炎相关通路和降低IL-6等细胞因子,进而保护了老年小鼠的认知功能。
二甲双胍与抗肿瘤作用
二甲双胍在抗肿瘤领域“大展神威”,早已不是新闻。
中国抗癌协会肿瘤内分泌专家委员会还发布了《二甲双胍辅助治疗合并2型糖尿病的恶性肿瘤患者的专家共识(2022年版)》,这是国内首个为二甲双胍在抗肿瘤方面的临床应用提供参考的较为权威的文件,包括在肺癌、乳腺癌、结直肠癌、前列腺癌、胃癌、肝癌等等多个癌种中发挥作用。
最近,来自上海交通大学的研究团队发现了二甲双胍治疗癌症的潜在机制——重塑结直肠癌(CRC)的免疫景观。具体来说,二甲双胍重编程了色氨酸代谢,减少了CRC细胞对色氨酸的吸收,恢复了CD8+ T细胞的色氨酸可用性,从而增强了T细胞抗肿瘤免疫。

单细胞转录组分析显示,与对照组相比,接受二甲双胍治疗的小鼠体内T细胞和B细胞出现了显著的扩增,而上皮细胞、先天淋巴样细胞、自然杀伤细胞和髓样细胞的比例有所减少。其中,在抗肿瘤免疫中起到关键性作用的CD8+ T细胞比例显著增加,同时细胞功能得到了增强。
进一步,研究者对CRC肿瘤微环境(TME)中细胞代谢活动的单细胞分析表明,色氨酸代谢的变化贯穿于整个治疗过程之中。具体来说,二甲双胍重编程了色氨酸的代谢,使得CRC细胞中的色氨酸有所减少,但促进CD8+ T细胞对色氨酸的代谢。
换言之,未接受治疗的情况下,CRC细胞和CD8+ T细胞之间相互竞争使用色氨酸,但CRC的能力明显更强,导致CD8+ T细胞功能受损。而二甲双胍的治疗减少了CRC细胞对色氨酸的摄取,相反恢复了CD8+ T细胞对色氨酸的可获得性,从而增强了其细胞毒性,包括CD8+ T细胞中干扰素g、肿瘤坏死因子a和颗粒酶B产生的增加。
更深层的机制分析显示,二甲双胍下调了转录因子MYC,从而降低了CRC细胞中色氨酸摄取转运体SLC7A5的mRNA表达,抑制CRC细胞对色氨酸的摄取;CRC细胞摄取的色氨酸减少了,CD8+ T细胞能够获得的色氨酸也就增加了。
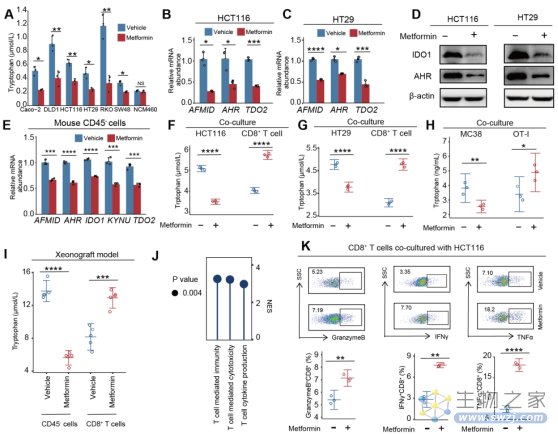
二甲双胍通过抑制CRC细胞对色氨酸的竞争来恢复CD8+ T细胞的功能
综上所述,研究者首次发现了二甲双胍能通过抑制结直肠癌细胞与CD8+ T细胞竞争色氨酸,增强后者的细胞毒性,从而驱动免疫介导的抗肿瘤作用。
二甲双胍与抗衰老作用
今年5月,《自然》子刊Nature Reviews Endocrinology发表重磅综述,全面地总结了二甲双胍在不同疾病领域中的最新发现,其中便提到了很有意思的一点——延长寿命。事实上,针对大量针对不同物种的研究,小到秀丽隐杆线虫和黑腹果蝇,大到一些啮齿类动物,结果均显示:二甲双胍能够延长中位和最高寿命,或有望成为抗衰老药物。
而来自斯坦福大学医学院的研究团队在人群队列中收集了表观遗传数据,以此来确定“二甲双胍对人类衰老和长寿的影响”。结果显示,二甲双胍会影响人类DNA甲基化,使其往有助于长寿的分子机制发展。

根据使用二甲双胍的情况,研究者人员将171名受试者(包括108名非糖尿病患者和63名糖尿病患者)分为二甲双胍使用者(Met)和非使用者(非Met),并比较了组间的全基因组DNA甲基化率差异。
结果显示,分析表观遗传图谱发现,无论是否患有糖尿病,Met组和非Met组的最大差异在于CpG位点、KEGG和GO通路。
对前330个CpG位点的富集分析显示,组间甲基化水平的绝对差异大于4%。
进一步的KEGG顶端信号分析显示了二甲双胍的可能作用途径,比如长寿调节途径、长寿调节途径-多物种和AMPK信号传导途径。此外,mTOR信号通路、胰岛素分泌、谷氨酸能突触和昼夜调节等也是其他的可能途径。
GO分析中发现了相关途径,如缺氧诱导因子-1α信号通路的调节和正向调节、典型的Wnt信号途径等等。
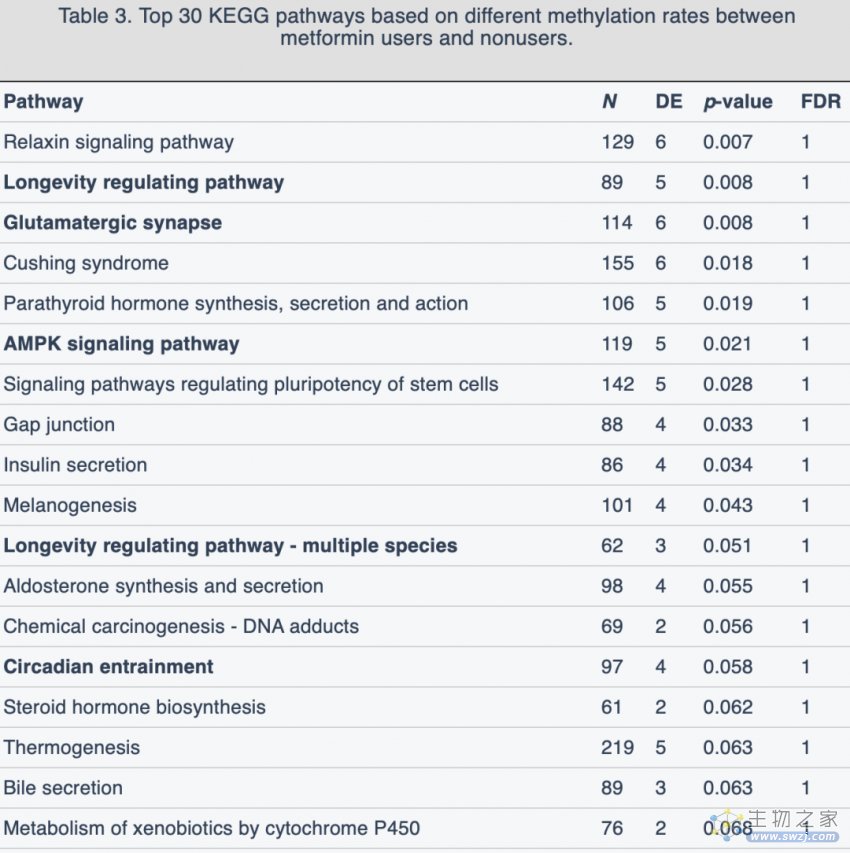
基于组间不同甲基化率的前30个KEGG途径
年龄加速分析结果则更为直观地展现了组间衰老速度的差异。具体来说,在糖尿病患者中,非Met组的平均年龄加速为-8.07,而该数值在Met组中仅为-4.47;在全部受试者中(无论是否患有糖尿病),这种差异略缩小但仍存在(非Met组-5.92 vs Met组-4.47)。
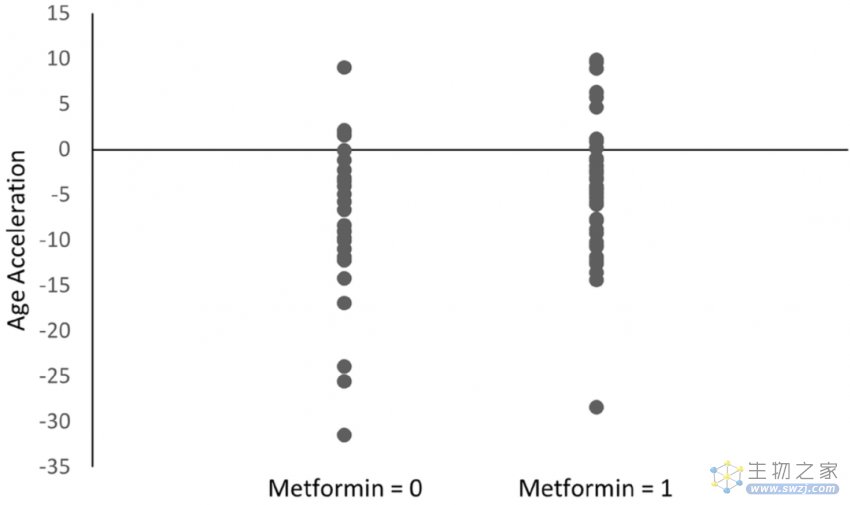
糖尿病组中Met组和非Met组之间的年龄增长差异
综上,全基因组DNA甲基化率的对比结果显示,二甲双胍能改变表观遗传进而延长人类的寿命,比如KEGG分析中的长寿调节途径以及AMPK信号通路在使用了二甲双胍后倾向于“有助长寿”的方向。
“神药”不愧为“神药”,竟有如此之多的作用。即使距二甲双胍首次合成已经过去了101年,但目前科学家仍未能完全阐明二甲双胍发挥治疗作用的各种领域以及潜在机制,也期待二甲双胍能给人类带来更多的惊喜!
参考文献:
[1]Zhu X, Shen J, Feng S, et al, which is enriched in the gut microbiota by metformin, improves cognitive function in aged mice by reducing the proinflammatory cytokine interleukin-6. Microbiome. 2023 May 30;11(1):120. doi: 10.1186/s40168-023-01567-1. PMID: 37254162; PMCID: PMC10228018.
[2]Huang X, Sun T, Wang J, et al. Metformin reprograms tryptophan metabolism to stimulate CD8+ T cell function in colorectal cancer. Cancer Res. 2023 May 17:CAN-22-3042. doi: 10.1158/0008-5472.CAN-22-3042. Epub ahead of print. PMID: 37195082.
[3]Marra PS, Yamanashi T, Crutchley KJ, et al. Metformin use history and genome-wide DNA methylation profile: potential molecular mechanism for aging and longevity. Aging (Albany NY). 2023 Feb 2;15(3):601-616. doi: 10.18632/aging.204498. Epub 2023 Feb 2. PMID: 36734879; PMCID: PMC9970305.































