以 CAR-T 为代表的细胞治疗是一种变革性的癌症治疗方法,在攻击血液瘤上表现亮眼。截止目前,全球共有 8 款 CAR-T 疗法上市,适应症也均为血液瘤。
不过,当前的 CAR-T 存在对实体瘤效果不明显、有一定毒性、体内治疗不持久、制造效率低、制备成本较高等问题,业内一直在探索破解这些难题的“最优解”。
近日,耶鲁大学 Sidi Chen(陈斯迪)研究团队为优化和增强细胞治疗提出了新的解决思路。科研团队提出了一种高效高通量定点基因敲入的工程化系统 CLASH(CRISPR-based library-scale AAV perturbation with simultaneous HDR knock-in)。CLASH 系统由 AAV+mRNA 两个部分组成,通过 AAV 递送其他元件、电穿孔递送编码核酸酶 Cas12a/Cpf1 的 mRNA 序列。
值得一提的是,通过体内外筛选,研究团队还首次发现去除 T 细胞 PRDM1 基因的第 3 号外显子之后,可以显著增强 CAR-T 在实体瘤中的治疗效果。
“回顾历史,基因编辑已经历了几十个年的发展,CRISPR 技术更是开启了基因编辑的黄金十年。然而,长久以来,基因敲入通常需要同源重组模板,这增加了细胞毒性,也降低了敲入效率,现阶段还难以做到大规模高通量基因敲入。CLASH 最大的突破点是在人类 T 细胞中实现了大规模高通量的定点敲入,可大规模改造细胞,并建立细胞库。”陈斯迪告诉生辉。
本文的第一作者是代晓云博士,她在陈斯迪实验室从事博士后研究,本年度即将开启自己的独立 PI 实验室。通讯作者陈斯迪现在是耶鲁大学医学院遗传学副教授,他本科毕业于北京大学生命科学院,博士毕业于芝加哥大学遗传演化生物学系,曾师从 1993 年诺贝尔生理学/医学奖得主 Phillip A. Sharp 教授。2015 年,陈斯迪开始在耶鲁大学独立建立课题组,实验室的重点研究方向是开发递送技术和工程化改造技术,并利用基因组编辑、高通量筛选技术、以及合成生物学等技术开发新型癌症免疫疗法、细胞治疗和基因治疗。

▲图|陈斯迪课题组,右一为陈斯迪(来源:受访者提供)
01
可高通量、高效、定点敲入基因片段
2012 年 6 月,Jennifer Doudna 和 Emmanuelle Charpentier 首次在体外证明 CRISPR/Cas9 系统可以切割任意 DNA 链,并指出 CRISPR 在活细胞中修改基因的能力。据悉,这是最早将细菌天然免疫系统演变成 CRISPR/Cas9 基因编辑工具发表的工作;2013 年初,张锋与 George Church 团队首次将 CRISPR/Cas9 技术应用于哺乳动物和人类细胞中。自此,CRISPR 基因编辑技术开始大放异彩,深刻改变着生命科学领域的“游戏规则”。
“2013 年前后,CRISPR 基因编辑技术虽然已实现了在细胞里面的定点插入,不过当时插入效率较低,大约只有 1%-5%。后续随着技术的升级优化,敲入效率得以提升,但是对于难以改造的 T 细胞而言,敲入效率相对还是较低。2015 年,业内通过电转方式提高了对 T 细胞敲除和敲入的效率,不过存在细胞毒性高、增殖受限等问题。长久以来,业内一直难以啃下大规模高效率在细胞内敲入基因这块硬骨头。”陈斯迪说。
2015 年加入耶鲁大学成立实验室后,陈斯迪实验室一直在寻找解决这一难题的方法。2019 年,该课题组开发出了一种通过 AAV 实现基因定点敲入和敲除的 KIKO 技术(knock-in and immune-checkpoint gene knockout),该技术可以在同一细胞中更高效生成两种不同的 CAR-T,效率达到 40%-50%。敲入效率得到了大幅度提升,但是通量较低,彼时是针对一个或者两个细胞完成的敲入和敲除。
经过 4 年多的进一步探索,研究团队在 KIKO 技术的基础上开发出了一种新型的工程化改造系统 CLASH。研究团队指出,与 KIKO 相比,CLASH 在通量上实现了质变,同时编辑数量从几个突变变为几千几万甚至更高的突变,并且将这些突变平行编辑于不同的细胞,新系统最大的优势就在于高通量、高效率和精准定点整合。
CLASH 由 AAV+mRNA 两部分组成。在实验中,研究团队首先将 CLASH 应用于 T 细胞,他们构建了 AAV 变体库,这些 AAV 上携带了编码同源重组的模板,并利用 AAV 递送 T 细胞重编程所需的元件,包括 CAR。同时,编码 Cas12a/Cpf1 核酸酶的 mRNA 序列会在体内翻译成 Cas12a/Cpf1 核酸酶,并切开 T 细胞基因组。此时,让大规模的 AAV 库感染大量不同的 T 细胞,AAV 会将基因片段定点整合到 T 细胞基因组中,从而实现对大量 T 细胞的修饰和改造,使之可以快速生成突变细胞库,比如 CAR-T 细胞库。
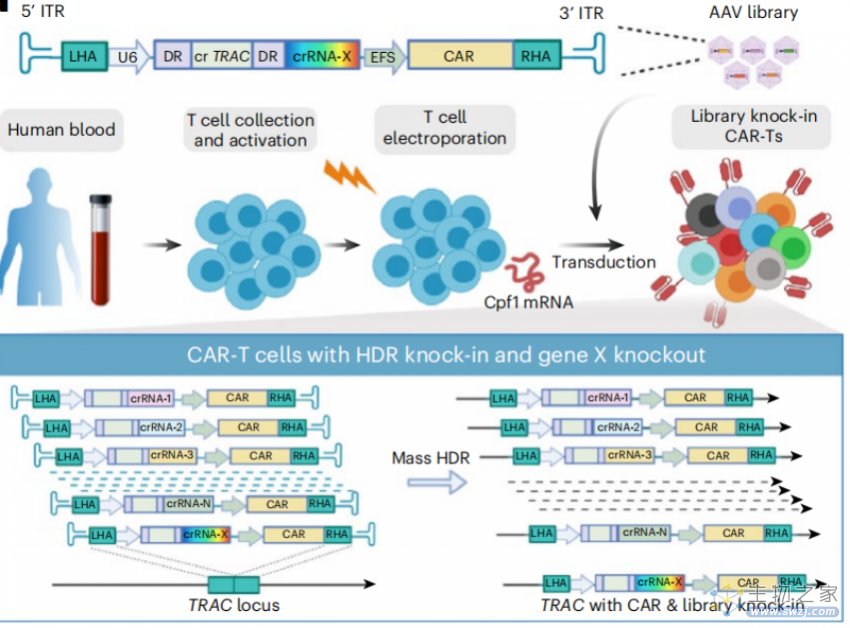
▲图|利用 CLASH 生成的 CAR-T 和 Descartes 文库同时敲入原理图(来源:NBT)
据陈斯迪介绍,CLASH 可以实现基因的敲入和敲除,敲入效率大约是 50%,敲除效率更高一些,整体超过 90%。在保证效率的基础上,CLASH 能够同时实现成千上万次敲除和敲入,高通量是该系统最大的亮点所在。
在实验中,研究团队通过电穿孔方法分别将 Cas12a/Cpf1 的 mRNA 序列递送到人原代 CD3、CD8 和 CD4 T 细胞,并在血液瘤和实肿瘤模型中进行了验证。
“当前的细胞治疗存在多种局限性,而 CLASH 这种高通量定点插入的方式可以一次性快速为一种癌症治疗方案创建不同基因修饰的数千种候选细胞疗法。这一定程度上缩短了细胞制备时间、减低制造成本,并有望提高细胞治疗效果。我认为,CLASH 方法在细胞和基因治疗研发方面极具优势,有助于业内开发‘下一代’治疗方法。”
02
发现 PRDM1 新机制,可显著增强 CAR-T 治疗效果
利用 CLASH 方法快速生成大量 CAR-T 细胞之后,研究人员通过体内外筛选等方式评估了 CLASH 方法,并试验了经基因改造的T细胞的治疗效果。这些转基因包括 TET2、PRDM1、KAT6B、PIK3CD、JADE1、BTNL3、PTPN11、PELI1、PRDM5、PTPN2、KDM4C、TDRD15 等等。
在 CLASH 试验中,研究人员通过体内和体外试验结果初步确定了 PRDM1 是 CAR-T 细胞治疗中一个非常具有前景的候选靶点,并重点探索了 PRDM1 基因修饰的全新生物学功能、评估了这种基因修饰对 CAR-T 细胞治疗效果的影响。
(来源:耶鲁大学官网)
PRDM1 即 PR 域锌指蛋白 1,是 B 细胞以及 T 细胞分化的重要调控因子,在免疫抑制中发挥关键作用。PRDM1 能够通过降低 T 细胞的增殖以及生存能力来调节免疫响应以及免疫平衡。
在试验中,研究团队首次发现,精准删除 PRDM1 的第 3 号外显子(crRNA 在 CAR-T 细胞中产生 Δexon3 剪切突变体)后,也就是破坏了 PRDM1 与核小体相互作用的区域之后,PRDM1 对T细胞的转录抑制功能也会相应被解除。这就像给 T 细胞松了“刹车”,与记忆性 T 细胞相关的基因表达也随之上调,从而使 T 细胞能够更有效和持久记住癌细胞、穿透癌细胞,达到显著增强 CAR-T 细胞治疗的效果。
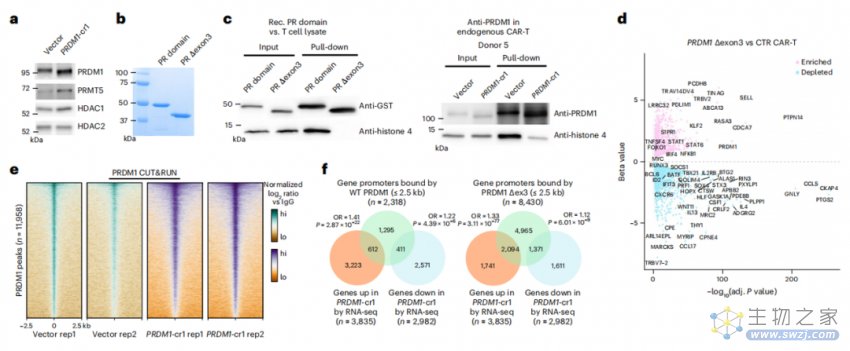
(来源:NBT)
陈斯迪指出,我们发现了 PRDM1 的全新生物学机理,新的机理也为成药带来了新突破和新途径。
在血流瘤肿瘤模型中,数据显示,PRDM1 Δexon3 CAR-T 细胞增强了治疗效果,以及增加了持久性和记忆标记物表达;接下来,研究人员进一步探索 PRDM1 Δexon3 CAR-T 细胞在实体瘤中的治疗潜力,体内数据证明了 PRDM1 Δexon3 HER2 CAR-T 细胞提高了对实体瘤的穿透力和杀伤力,显著增强了抗肿瘤活性。
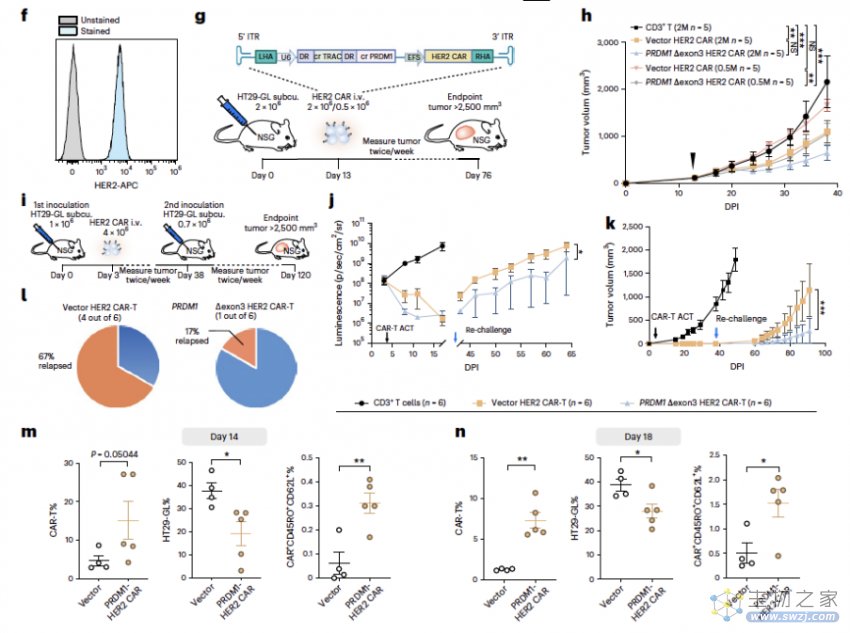
(来源:NBT)
“这些数据令人振奋,我们希望能够将这些发现推进临床试验,早日攻克实体瘤。”陈斯迪说。
03
新系统具有通用性,已授权公司转化
论文中指出,CLASH 技术具有通用性,并不局限于 T 细胞改造设计,未来通过改变 AAV 结构或者文库设计可以应用于 NK 细胞、B 细胞、巨噬细胞等免疫细胞、干细胞以及其他类型的细胞。
陈斯迪透露,接下来还会从技术应用方向和技术的深度和精度上下功夫,进一步提高精准度,发现新的生物学机理,从底层技术上取得突破,显著增强细胞和肿瘤免疫治疗的疗效。
研究团队在通稿中指出,通过 CLASH 等高度通用的平台和其他技术设计多种类型的原代人体细胞,可以为患者带来先进的治疗方法。现阶段,研究团队有将 CLASH 技术转化的考虑和规划。
陈斯迪告诉生辉,CLASH 技术具有广泛与深度的应用潜力,目前已经将该技术的商业化权益授权给 Cellinfinity Bio 公司。

(来源:businesswire)
这是一家成立于 2021 年的癌症免疫细胞治疗公司,由陈斯迪创立,2022 年 6 月,Cellinfinity Bio 完成了 1320 万美元的种子轮融资。此前他创办的免疫治疗平台公司 EvolveImmune Therapeutics 完成 3500 万美元 A 轮融资。
根据官网的介绍,该公司正在通过定向进化新型技术开发“下一代”具有变革性的细胞疗法。该公司使用定向进化实验识别基因修饰和 CAR 构建体,这些基因修饰和 CAR 构建体可显著改善工程免疫细胞的抗癌功能。目前,Cellinfinity Bio 的产品管线包括针对多种实体瘤的工程化T细胞、NK 细胞等免疫细胞治疗。

(来源:Cellinfinity Bio )
接下来,Cellinfinity Bio 将会基于 CLASH 技术 与及未发表的新技术和新生物学机制进行研发,开发新药并推进临床管线。
参考资料:
1.https://www.nature.com/articles/s41587-022-01639-x
2.https://www.nature.com/articles/s41592-019-0329-7
3.https://medicine.yale.edu/news-article/yale-scientists-enable-massively-parallel-dna-insertions-into-human-cells/
4.https://www.businesswire.com/news/home/20230126005789/en/Cellinfinity-Bio-Announces-Publication-and-Licensing-of-Key-Technology-for-Directed-Evolution-of-Cells-That-Allows-for-More-Effective-Adoptive-Cell-Therapy































