婴儿期和儿童期是适应性免疫发育和成熟的关键时期,在此期间,免疫系统建立了对病原体的保护性免疫以及对无害微生物和环境抗原的耐受性。在这个窗口期内,T细胞介导的反应可以为终身保护和健康奠定基础,但也容易造成免疫反应失调,包括过敏和炎症性疾病【1,2】。尽管众所周知,在婴儿期和儿童期感染和接种疫苗可以产生免疫记忆和终身保护性免疫,但人类这一生命阶段中T细胞记忆发育的时间、位置和途径仍然难以捉摸。毫无疑问,全面了解生命早期人类T细胞分化和记忆形成,并确定儿童记忆T细胞何时达到功能成熟,对于制定针对儿童的免疫监测、疫苗接种和免疫治疗策略是非常必要的。
2023年7月7日,来自美国哥伦比亚大学的Donna L. Farber团队在Immunity上在线发表题为 Site-specific development and progressive maturation of human tissue-resident memory T cells over infancy and childhood 的文章,分析了婴儿期和儿童期淋巴器官、黏膜部位和血液中人类记忆T细胞的发育情况,发现与血液和淋巴器官相比,记忆T细胞在婴儿期优先定位于肠道和肺部,且在黏膜部位积聚得更快,并表现出年龄和组织驱动的成熟过程,由此确定了成长期靶向组织的记忆T细胞的阶段性发展,为促进和监测儿童的免疫力提供了重要的信息。

本研究的研究人员对来自96名0-10岁的儿童器官捐献者和研究参与者的样本进行了表型、功能和转录组分析,以确定与成人组织相比,T细胞在婴儿期和儿童期如何定位组织并形成免疫记忆。首先,研究人员通过对肺和肠的共聚焦成像,研究了生命早期T细胞定位黏膜部位的程度。定量免疫荧光(IF)分析显示,在几周龄时,每个部位的常规αβ T细胞和γδ T细胞(个体早期发育的限制性多样性淋巴细胞)密度较低;在3岁以前,肺和肠中的αβ T细胞密度显著增加,而且每个部位的积累动力学相似(分别为1.3岁和1.4岁),γδ T细胞则没有明显改变。
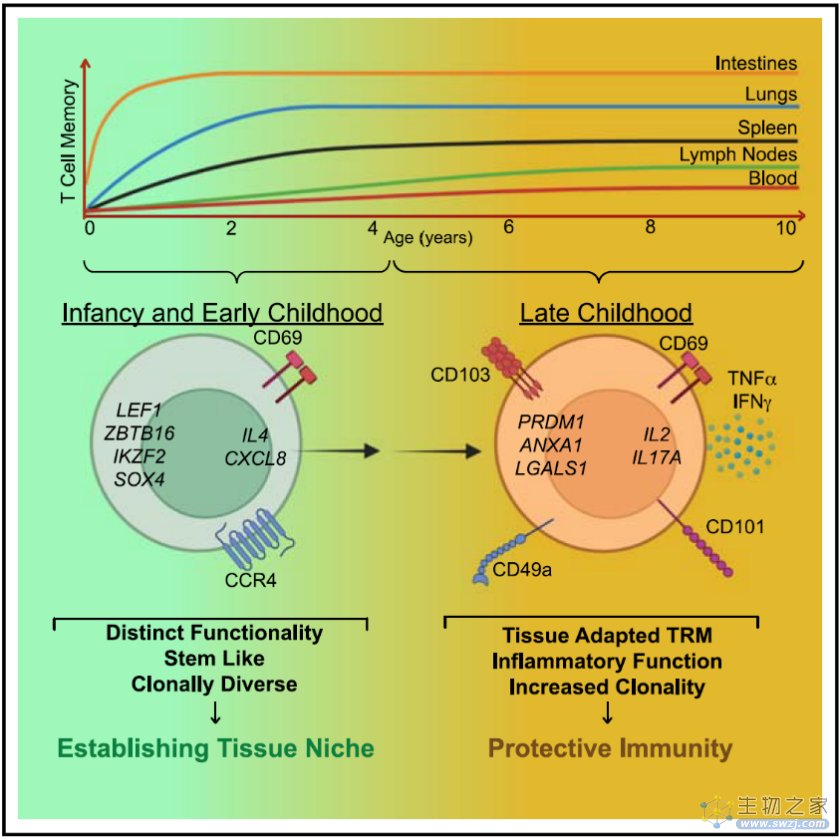
婴儿早期黏膜部位αβ而非γδ T细胞的逐渐增加提示了抗原驱动的效应和记忆T细胞的产生,基于此假设,研究人员使用CD45RA和CCR7表达来描述儿童捐赠者血液和组织中的初始和先前激活的或记忆亚群,包括效应记忆 (TEM),中央记忆 (TCM)和末端效应 (TEMRA) T细胞。结果显示,出生的第一年,原始CD4+和CD8+T细胞是淋巴器官和肺部的主要αβ T细胞亚群,而CD4+和D8+TEM(和CD8 TEMRA)细胞甚至在出生时就存在于肠道部位。从2岁到10岁,CD4+和CD8+ TEM细胞在肠道和肺部占主导地位,在淋巴器官中表现出相当高的频率。在所有年龄段,TCM细胞在CD4+细胞中比CD8+ T细胞更普遍,在血液、淋巴组织和结肠中发现的频率较低,而TEMRA细胞主要在肺、脾和肠的CD8+ T细胞中发现。这些结果表明在出生早期和儿童期,记忆细胞亚群的区隔化主要发生在黏膜部位。为了更清楚地描述随着年龄的增长,记忆T细胞在每个部位的积累,研究人员绘制了总记忆T细胞(TEM+-TCM+TEMRA)的增加和伴随而来的原始T细胞频率随年龄的下降,结果显示黏膜部位(肺、小肠和大肠)的积累呈指数级增加,而血液和淋巴器官的积累则呈线性逐渐增加,从而证实记忆T细胞积聚的速率和幅度是部位特异性的,并且在黏膜和淋巴组织部位之间显著不同,而且婴儿期基于T细胞的快速记忆形成表现在组织中,而非血液中。位点和时间是记忆T细胞产生和初始T细胞维持的关键因素。
进一步地评估TEM细胞的内在功能能力,研究人员发现,不同谱系、不同部位和不同年龄段的关键促炎细胞因子干扰素-γ(IFN-γ)和/或肿瘤坏死因子-α(TNF-α)的产生存在差异,证明了儿童记忆T细胞功能能力具有组织特异性差异。随着年龄的增长,研究又发现记忆T细胞效应功能在所有部位都发生了进行性变化。所有实验结果揭示了儿童记忆T细胞的三个重要方面:(1)生命早期记忆T细胞在功能上反应低下,与部位无关;(2)记忆T细胞在儿童时期功能成熟;(3))记忆T细胞功能成熟的程度和动力学是部位特异性的。
组织驻留记忆T(TRM)细胞在先前抗原暴露的部位产生,主要存在于黏膜和屏障部位,在小鼠感染模型中对协调快速保护反应至关重要。在人类中,TRM细胞具有核心表型、功能和转录特征,并构成成人黏膜和外周组织中的大部分T细胞。已有研究发现包括肺和肠在内的特定部位的TRM细胞比例在成年期保持稳定,表明TRM形成的动态事件发生在生命的早期。本文研究人员发现,黏膜记忆T细胞表达TRM的典型标记物CD69是组织定位的一个特征,不依赖于年龄,即使在出生时,所有组织中的记忆T细胞都表达TRM细胞的核心表型标记,从而将它们与血液中的记忆T细胞区分开来。其他核心TRM细胞标志物的表达,包括上皮和胶原结合整合素CD103和CD49a、趋化因子受体CXCR6和负调节因子CD101,都显示出在不同部位和年龄的表达差异,从而为儿童TRM在人类生命的头十年中的动态成熟和组织适应提供了证据。
随后,为了阐明生命早期黏膜记忆T细胞发育成熟的潜在机制,研究人员评估了它们在婴儿期和儿童期的基因表达谱,直接比较具有TRM样表型的记忆T细胞在不同年龄段的转录特性。实验结果表明,生命早期记忆T细胞的转录谱发生了显著的变化,从缺乏某些效应功能和组织驻留特征的干细胞样细胞状态转变为表达核心特征分子、组织适应和效应功能基因的完全分化的TRM细胞。这些转录结果也与上述TRM细胞表面表型和细胞因子产生的逐渐增加的表达一致。考虑到CD4+ T细胞效应功能的异质性,研究人员使用RNA-seq数据进一步研究了黏膜记忆CD4+ T细胞的细胞因子基因在不同年龄段的表达变化,发现在肺部和肠道部位,CD4+T细胞表现出与年龄相关的细胞因子表达变化。与4岁以上儿童的记忆性CD4+T细胞相比,黏膜记忆CD4+ T细胞在生命早期的功能变化倾向于Th2样细胞因子和某些炎症介质的产生,而前者表现出成熟的Th1样特征和依赖于部位的可变的IL-17的产生。
抗原暴露导致T细胞的克隆扩增,为了研究不同年龄段T细胞记忆的形成是否与特定克隆在组织内或组织间的扩增有关,研究人员研究了T细胞受体(TCR)库,包括克隆扩增、分别和跨部位重叠,实验结果证明生命早期记忆T细胞存在扩增和组织分离的克隆,这些克隆在儿童期变得扩增增加并可在相邻部位之间迁移。
综上所述,本研究提供了在生命早期和儿童期的关键发育窗口的多种组织和血液中T细胞发育和记忆形成的高纬度分析;建立了促进免疫记忆区域专门化的时间、定位和发育途径;确定了T细胞记忆发展的关键里程碑,包括在高抗原暴露的黏膜部位的快速动员,以及与年龄相关的组织驻留和功能能力的获得,从而导致记忆的区域专门化以获得强大的保护性免疫,证明了生命早期和儿童期适应性免疫的组织定向成熟,为建立终身免疫保护和健康提供了可靠的蓝图。
原文链接:
https://doi.org/10.1016/j.immuni.2023.06.008
参考文献
1.Bach, J.F. (2002). The effect of infections on susceptibility to autoimmune and allergic diseases. N. Engl. J. Med. 347, 911–920.
2.Reynolds, L.A., and Finlay, B.B. (2017). Early life factors that affect allergy development. Nat. Rev. Immunol. 17, 518–528.































