衰老(aging)和癌症等重要病理过程与细胞衰老(cellular senescence)之间的紧密联系引起了大量的研究兴趣,起初的主流观点认为细胞衰老是一种有效的抑癌机制,因为它限制了受损细胞的增殖能力【1】。而后来越来越多的研究发现细胞衰老也可以发挥促癌作用,其原因可能和衰老相关分泌表型(senescence-associated secretory phenotype,SASP)相关,衰老细胞在肿瘤微环境中的积累可以通过SASP以旁分泌方式驱动肿瘤发生【2】。然而,由于衰老的异质性以及缺乏特异性标志物,细胞衰老的研究一直非常困难,细胞衰老目前最有力的标志物是细胞周期蛋白依赖性激酶CDK抑制因子p16INK4a,研究发现p16INK4a的表达能够延迟衰老小鼠自发肿瘤的的发生,延缓癌症的发展【3】。
近日,来自英国伦敦大学学院儿童健康研究所的Scott Haston、Juan Pedro Martinez-Barbera和英国剑桥大学肿瘤系Daniel Muñoz-Espín研究小组在Cancer Cell杂志上发表题为Clearance of senescent macrophages ameliorates tumorigenesis in KRAS-driven lung cancer的研究论文,这篇文章在KRAS驱动的肺癌小鼠模型中发现了具有促肿瘤活性的衰老巨噬细胞群,这些巨噬细胞在正常衰老的肺中显示出细胞衰老和SASP特征,同时还在人类癌前肺肿瘤中验证了表达衰老标志物的巨噬细胞的存在。

首先,该研究小组将优化的flippase重组酶(FLPo)和白喉毒素受体(DTR)/mCherry融合蛋白插入胚胎干细胞Cdkn 2a(p16)基因座的3′端,成功繁育了一种适合衰老研究的新款小鼠:p16-FDR小鼠(图1)。p16INK4a的表达几乎在这个小鼠的所有组织中都增加了,同时,与年轻p16FDR/+小鼠相比,老年小鼠中表达mCherry的细胞数量在大脑、肺、肾、心脏、脂肪组织和肾上腺中显著增加。此外,在脊髓、肝脏、骨骼肌、食道和骨髓中观察到mCherry阳性细胞数量也表现为增加的趋势。因此,p16-FDR小鼠模型可用于细胞衰老研究。
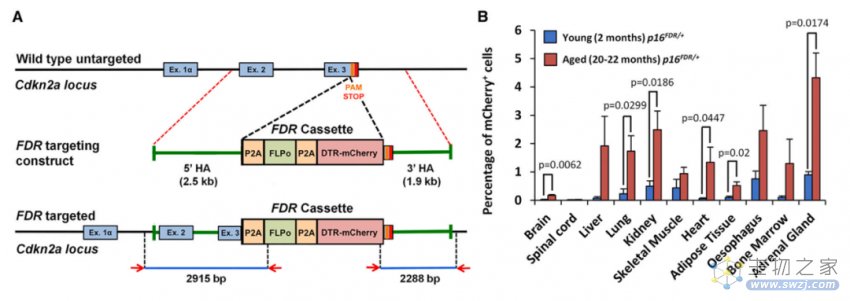
图1: 成功繁育适合衰老与肿瘤研究的p16-FDR小鼠
为了研究p16INK4a在KRAS驱动的非小细胞肺癌(NSCLC)发展过程中的作用,作者继续繁育了KrasG12D/+;p16FDR/+;Rosa26loxP-STOP-loxP-YFP/+三杂合小鼠(以下简称KY-FDR,图2)。在这些小鼠中,Cre介导的Kras-G12D和Rosa26等位基因的重组导致致癌Kras-G12D和YFP同时表达,YFP标记Kras,对Kras-G122D转化的肿瘤细胞进行遗传追踪,mCherry标记表达p16INK4的细胞。该小鼠具有衰老特征的p16INK4a表达细胞主要存在于肺肿瘤微环境中,这类细胞具有细胞衰老和SASP特征。
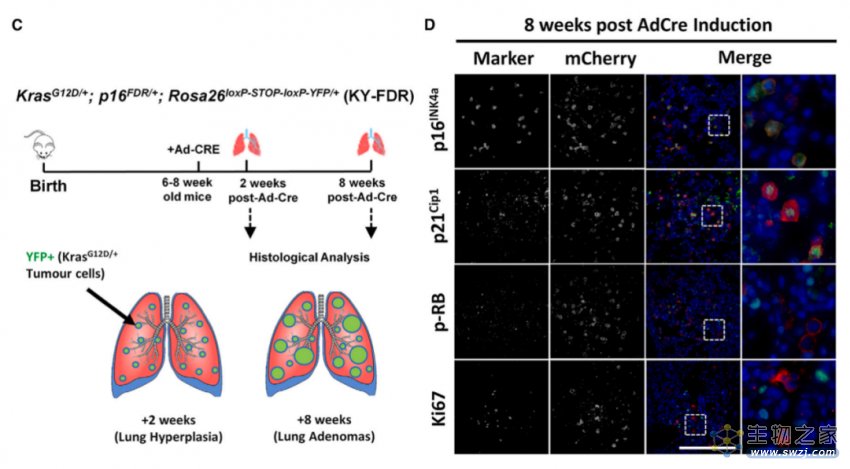
图2: 成功繁育KrasG12D/+;p16FDR/+;Rosa26loxP-STOP-loxP-YFP/+三杂合小鼠
KRAS驱动的肺肿瘤中主要衰老细胞类型是什么?作者使用xCell对RNA测序数据集进行计算预测,又对mCherry和YFP标记的细胞进行了免疫荧光染色,结果发现肺癌细胞和衰老肺细胞表达p16INK4a的衰老巨噬细胞比例明显更大。巨噬细胞以及部分内皮细胞激活了p16-FDR等位基因,巨噬细胞和内皮细胞是KRAS驱动的肺肿瘤中主要的衰老细胞类型。同时,作者对KY-FDR小鼠肺中表达p16INK4a和不表达p16INK4a的细胞进行了10x单细胞测序,证实肺中表达肿瘤和年龄相关p16INK4a的巨噬细胞和内皮细胞具有衰老特征,巨噬细胞表现出特异性SASP特征。
接下来作者测试了用于清除p16INK4a的白喉毒素(DT)以及senolytic-ABT-737对肺肿瘤的影响,在KRAS驱动的NSCLC小鼠模型中,清除表达p16INK4a的衰老细胞,包括巨噬细胞和内皮细胞群,显著降低了肿瘤负荷,从而提高了小鼠存活率。表达CSF1R的巨噬细胞(包括mCherry+/CD68+巨噬细胞)直接促进了肿瘤进展,是肺癌肿瘤微环境中的关键参与者,阻断CSF1R信号清除巨噬细胞会出现与清除衰老细胞相似的表型。DT以及senolytic-ABT-737对衰老细胞的清除导致T细胞表型向免疫刺激性肿瘤微环境转变,成功破坏了肿瘤内血管网络,从而可能减少了营养物质和O2向肿瘤细胞的输送。最后作者在人标本中进行了验证,与小鼠实验一致,人类癌前肺部病变含有表现出衰老特征的巨噬细胞细胞群。
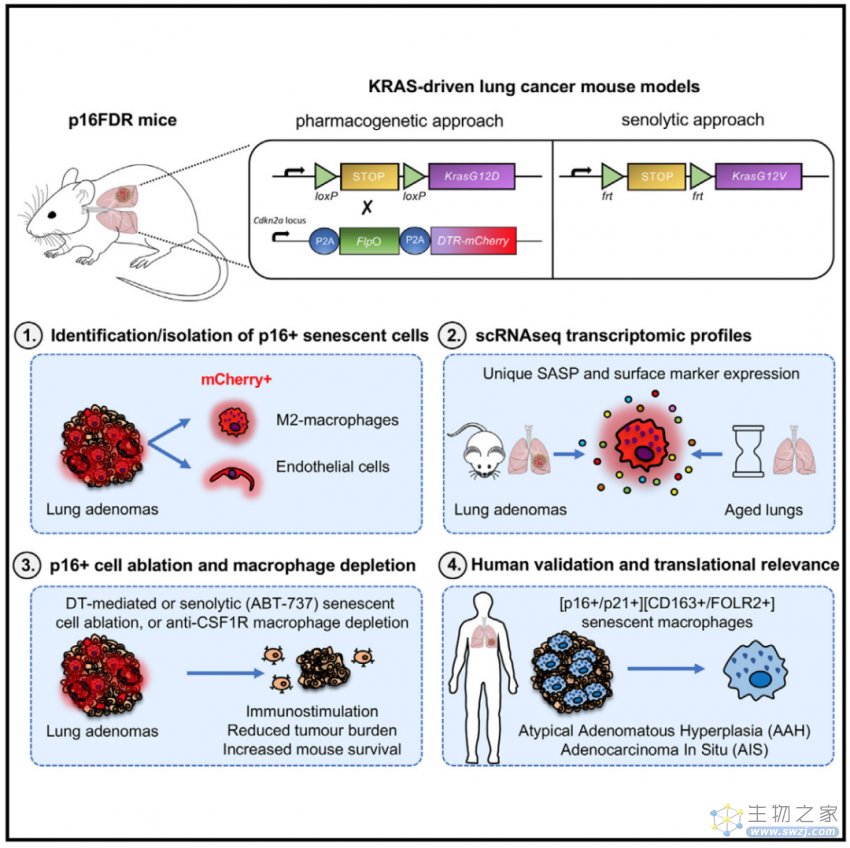
图3:清除衰老巨噬细胞降低KRAS驱动的肺肿瘤发生
综上所述,作者繁育了新的p16-FDR小鼠,发现巨噬细胞和内皮细胞是小鼠KRAS驱动的肺肿瘤中主要的衰老细胞类型,清除衰老细胞或巨噬细胞能够显著降低肿瘤负担并提高生存率。这项研究揭示了衰老巨噬细胞在癌症发生和发展中的重要作用,为癌症预防和治疗提出了新的途径。
原文链接:
https://doi.org/10.1016/j.ccell.2023.05.004
参考文献
1. M. Collado, M. Serrano. Senescence in tumours: evidence from mice and humans. Nat. Rev. Cancer, 10 (2010), pp. 51-57.
2. D.V. Faget, Q. Ren, S.A. Stewart. Unmasking senescence: context-dependent effects of SASP in cancer. Nat. Rev. Cancer, 19 (2019), pp. 439-453,
3. S. He, N.E. Sharpless. Senescence in health and disease. Cell, 169 (2017), pp. 1000-1011































