近段时间,我国已经监测到包括BQ.1、XBB在内的130多个奥密克戎的亚分支输入我国。“阳了”似乎已经成为了人们最大的共同语言。当新冠病毒敲开了人体的大门,便打开了这场病毒与免疫系统的战争。
根据韩国媒体报道,新冠病毒击毁人体内免疫细胞,导致人体免疫力下降,让病毒更容易在人体内扩增。
大量的研究证明,我们的免疫系统会以更强大的力量“反击”新冠病毒,其中起到关键作用的便是我们的免疫细胞。
1
病毒大量摧毁人体免疫细胞
新型冠状病毒肺炎全球大爆发,医学界研究发现,新冠病毒会如艾滋病毒般攻击人体免疫系统。
还有研究提出,新冠病毒等冠状病毒感染人体,可能导致淋巴细胞减少、淋巴结萎缩甚至耗竭。王福生院士团队发布在《柳叶刀》上的全世界首例新型冠状病毒肺炎病理解剖报告中揭示,患者外周血T淋巴细胞数量大大减少。

还有研究发现,NK免疫细胞在新冠病毒感染的急性期发生快速变化。比如,相比健康个体,新冠重症患者的NK细胞总数显著减少,甚至耗尽;而在治疗后恢复的患者中,NK细胞的数量恢复;这表明NK细胞的功能耗竭与新冠病毒感染有关。
2
人体T细胞免疫反应可有效应对奥密克戎
尽管,新冠病毒对人体免疫细胞带来影响,但人们攻克这种病毒的最强大武器仍然是免疫细胞。
由香港科技大学和墨尔本大学共同进行的一项研究显示,尽管新冠病毒变异株Omicron较其他变异株包含更多基因突变,但人类赖以防御病毒的T细胞免疫反应,仍能应对Omicron带来的挑战。通过接种新冠疫苗或经感染新冠肺炎后所产生的T细胞,能有效清除被感染的细胞,并促进其他免疫反应,对控制病情恶化至关重要。
早前有研究报告指,现正迅速成为全球最流行的新冠病毒Omicron变异株,能够避开由疫苗接种或感染新冠肺炎后所产生的抗体免疫反应,引起大众对疫苗防线被突破,或痊愈病人可遭受二次感染的忧虑。不过,科大及墨尔本大学团队于科学杂志《病毒》中发表研究结果显示[1],Omicron实则难以透过突变,逃脱T细胞免疫反应的攻击(图1)。这些结果在美国加州拉霍亚免疫研究所团队关于T细胞对新冠病毒免疫反应的研究佐证不谋而合。
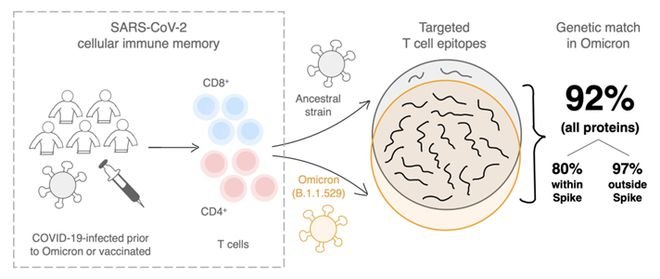
(图1,来自文献1)
美国加州拉霍亚免疫研究所从2020年开始连续发表数篇研究均聚焦SARS-CoV-2的T细胞研究。2020年的时候该研究所在国际顶级期刊《细胞》(cell)杂志发表文章[2]:基于对恢复期COVID-19患者外周血细胞的多个测试结果,研究团队在70%的受试者中检测到了病毒特异性CD8+ T杀伤细胞且100%受试人群检测到病毒特异性的CD4+T细胞(图2)。
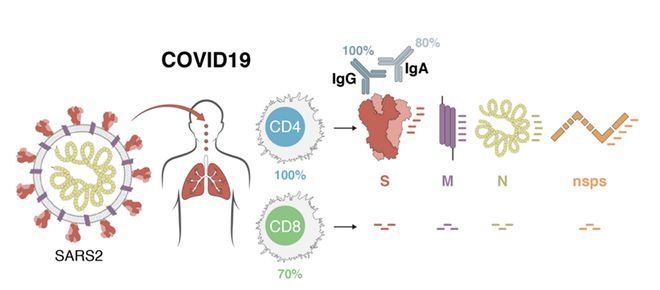
(图2,处于恢复期COVID-19受试者中,80%外周血检测到病毒特异性CD8+T杀伤细胞且100%外周血检测到病毒特异性的CD4+T细胞,来自文献2)
之后病毒不断出现变异,而这些突变通常发生在刺突蛋白,从而影响抗体对其的结合能力和中和功能,使病毒能够从人体的免疫系统逃逸。
于是拉霍亚免疫研究所随即对2020年感染SARS-CoV-2后处于恢复期的病人的外周血样本进行了研究[3]:用SARS-CoV-2变异毒株的刺突蛋白孵育外周血后进行检测。数据表明,刺突蛋白活化的T细胞反应与突变体毒株无关,不同毒株的突变并未影响T细胞反应(图3)。这些证据都证明了T细胞反应在SARS-CoV-2研究中的重要性。
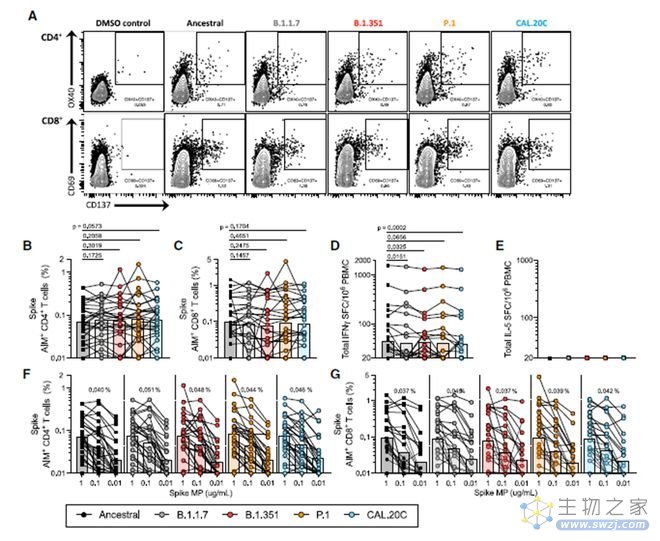
(图3,原始病毒株和各突变株对应的刺突蛋白刺激COVID-19恢复期个体T细胞反应,结果显示,刺突蛋白活化的T细胞反应与突变体毒株无关,来自文献3)
有趣的是,研究人员在未暴露的健康个体中也检测到T细胞对SARS-CoV-2的反应性(图4),表明一些低致病性的冠状病毒可能和SARS-CoV-2之间存在T细胞识别的交叉反应。相似的情况在新加坡的一项研究中也得到证实。据联合早报称,新加坡研究发现,无症状病患体内对冠病病毒产生强烈的T细胞免疫反应,结合抗体功效后,可防止患上重症。
T细胞能够在新冠病毒中发挥免疫反应的重大发现,帮助人们明确了机体免疫反应在病毒清除中的重要作用,也让人们意识到免疫细胞对机体健康的强大保障。
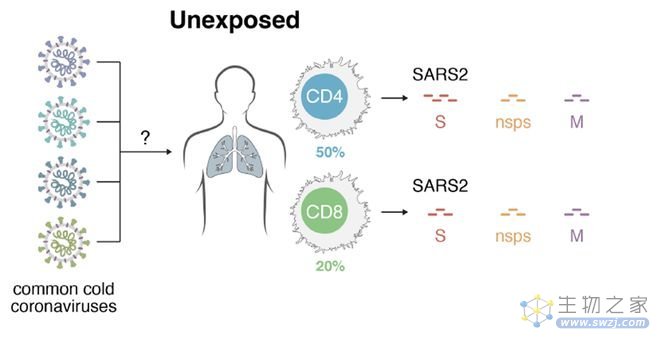
(图4,在未暴露的个体中也检测到T细胞对SARS-CoV-2的反应性,来自文献2)
3
免疫细胞是机体的健康卫士
免疫细胞是人体最重要的健康卫士。不论是细菌、病毒,还是“胡作非为”的癌细胞、占位置不干活的衰老细胞,都是免疫细胞清除的对象,也正是如此,我们的健康才得以维护。
免疫细胞,俗称白细胞,是一类参与免疫应答或免疫应答相关的细胞,主要包括淋巴细胞群、单核细胞、巨噬细胞和树突状细胞等。T细胞是淋巴细胞的重要组成部分,是人体细胞免疫功能的主要执行细胞群。

2019年来自德国的马丁路德大学和德国汉堡-埃彭多夫大学研究团队就发现:随着年龄的增加,T细胞的多样性逐渐减少。40岁后,更是呈明显下降趋势。研究团队经过对健康人、实体瘤患者以及血液瘤患者的T细胞分析,结果显示:癌症患者比健康人士的T细胞更少;同时,随着年龄的增长,癌症患者体内T细胞的下降速度,也比健康人更快。
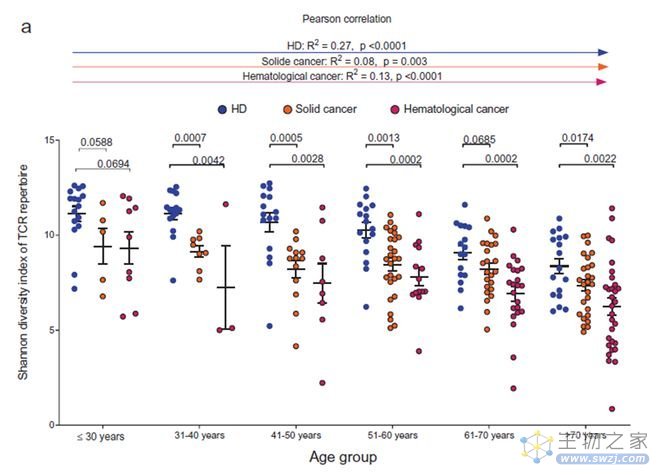
(图5,随着年龄的增加,免疫细胞T细胞的多样性逐渐减少,来自文献4)
2021年5月,美国明尼苏达大学的研究人员在国际顶尖学术期刊《Nature》上发布一项重磅成果[5]:免疫细胞的衰老会导致实体器官衰老,从而促进全身衰老。研究人员还发现给年轻小鼠移植衰老免疫细胞,会促进衰老进程;给衰老小鼠移植年轻免疫细胞,可以部分逆转衰老进程。
4
存储健康的免疫细胞,为对抗未知疾病风险作准备
随着年龄增加,环境恶化,压力剧增都会导致人体患病几率增高,人类对免疫细胞的需求越来越大,然而免疫细胞的活性和数量却在衰退。有什么办法可以让免疫细胞保持年轻健康时的活性和数量呢?答案是,免疫细胞存储。

免疫细胞储存是指利用先进的生物技术,从人体血液中提取一定数量的免疫细胞,储存在-196℃的液氮罐中。在-196℃的低温条件下,细胞的生命活动几乎停止,细胞处于休眠状态,待需要时再进行复苏和扩增。细胞经低温储存复苏后,仍具有正常的生物学活性。
如果能够趁年轻健康,存储年轻活力的免疫细胞就是给自己身体储备了免疫力,当我们面对未来难以对抗的疾病风险时,可以随时调动这支储备队伍,帮助机体共渡难关。
参考文献:
[1].Ahmed SF, Quadeer AA, McKay MR. SARS-CoV-2 T Cell Responses Elicited by COVID-19 Vaccines or Infection Are Expected to Remain Robust against Omicron. Viruses. 2022 Jan 2;14(1):79.
[2] Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, Rawlings SA, Sutherland A, Premkumar L, Jadi RS, Marrama D, de Silva AM, Frazier A, Carlin AF, Greenbaum JA, Peters B, Krammer F, Smith DM, Crotty S, Sette A. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell. 2020 Jun 25;181(7):1489-1501.e15.
[3]. Tarke A, Sidney J, Methot N, Yu ED, Zhang Y, Dan JM, Goodwin B, Rubiro P, Sutherland A, Wang E, Frazier A, Ramirez SI, Rawlings SA, Smith DM, da Silva Antunes R, Peters B, Scheuermann RH, Weiskopf D, Crotty S, Grifoni A, Sette A. Impact of SARS-CoV-2 variants on the total CD4+ and CD8+ T cell reactivity in infected or vaccinated individuals. Cell Rep Med. 2021 Jul 20;2(7):100355.
[4] Simnica D, Akyüz N, Schliffke S, Mohme M, V Wenserski L, Mährle T, Fanchi LF, Lamszus K, Binder M. T cell receptor next-generation sequencing reveals cancer-associated repertoire metrics and reconstitution after chemotherapy in patients with hematological and solid tumors. Oncoimmunology. 2019 Jul 25;8(11):e1644110.
[5] Yousefzadeh MJ, Flores RR, Zhu Y, Schmiechen ZC, Brooks RW, Trussoni CE, Cui Y, Angelini L, Lee KA, McGowan SJ, Burrack AL, Wang D, Dong Q, Lu A, Sano T, O'Kelly RD, McGuckian CA, Kato JI, Bank MP, Wade EA, Pillai SPS, Klug J, Ladiges WC, Burd CE, Lewis SE, LaRusso NF, Vo NV, Wang Y, Kelley EE, Huard J, Stromnes IM, Robbins PD, Niedernhofer LJ. An aged immune system drives senescence and ageing of solid organs. Nature. 2021 Jun;594(7861):100-105.































