肺癌有着极高的死亡率,晚期肺癌患者的预后常常较差。目前已经开发出基于基因检测技术的分子靶向治疗,可以明显延长晚期肺癌患者的总生存期并提高生活质量。为了提出个性化治疗方案,临床医生需要依据检测到的肿瘤驱动因子突变,来选择特定的分子靶向药物用于癌症治疗。然而肺癌治疗仍存在诸多难题,因此,亟需建立一个模拟原始肿瘤形态学和基因组特征的体外药敏试验模型来预测肺癌靶向和化疗的疗效。
近日,广东省肺癌研究所的研究人员及其合作者在《细胞》子刊《细胞报告医学》(Cell Reports Medicine)上,发表了题目为“Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: A real-world study”的研究论文,研究结果显示,基于肺癌类器官的药物敏感性测试结果可准确预测肺癌靶向或化疗的临床疗效。这也是目前国际上肺癌类器官领域预测靶向和化疗疗效的最大样本量真实世界研究。
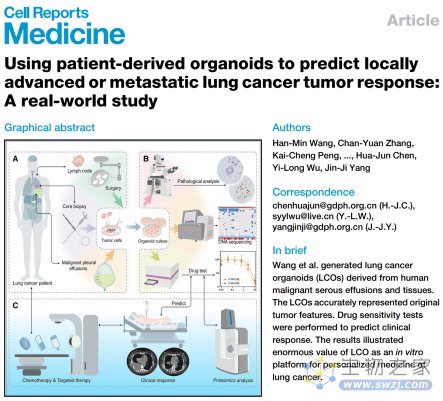
在这项研究中,研究人员从107名晚期癌症患者中生成了214个癌症类器官,总成功率为75.7%(162/214),其中212个是肺癌类器官(LCO),主要来源于恶性浆液性渗出液(MSE),研究流程如下图所示。另外,研究人员还在真实世界研究中进行了针对化疗和靶向治疗的肺癌类器官药物敏感性测试(LCO-DST),用于预测相应治疗的临床反应。
图注:研究流程图和本研究中肺癌类器官培养的成功率。(来源:Wang, H., et al. 2023)
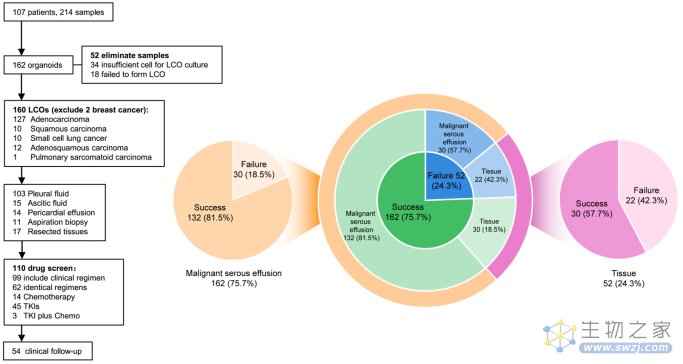
为了验证恶性浆液性渗出液和恶性浆液性渗出液来源的肺癌类器官之间基因组图谱的一致性,研究人员对25名患者进行了二代测序,并对积液和肺癌类器官样本进行了体细胞突变分析,如下图所示。这些数据显示肺癌类器官样本的变异敏感性为70.5%(93/132),阳性预测值为69.4%(93/134)(图C)。
而且,基于肺癌类器官的肿瘤突变负荷(TMB)与基于积液的肿瘤突变负荷呈正相关(Pearson r=0.68,p=0.02,图E),说明积液和肺癌类器官样本之间的基因组图谱具有一致性,即类器官可以反应其同源组织的遗传背景。
图注:肺癌类器官样本的基因组分析。(来源:Wang, H., et al. 2023)
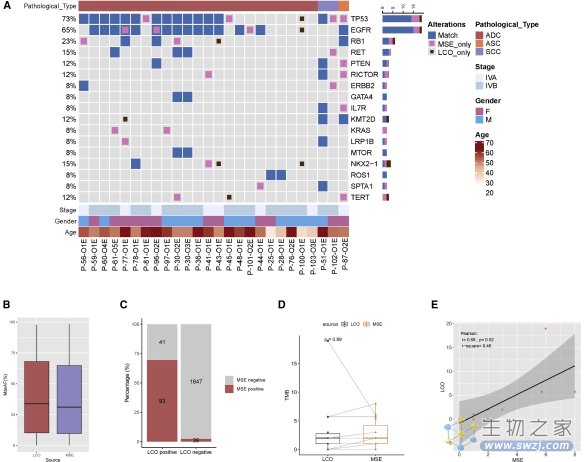
研究人员将36名患者临床方案与LCO-DST结果相同的肺癌类器官分为四类:奥西莫替尼、化疗、双靶向治疗和其他靶向治疗组。使用接受者操作特征(ROC)分析来确定LCO-DST区分临床敏感或耐药患者的能力。LCO-DST的总体灵敏度为84.0%(95%可信区间,63.08%-94.75%),特异性为82.8%(95%可信区间,63.51%-93.47%),准确性为83.3%(图A、B)。这些结果表明,肺癌类器官可以预测未治疗和治疗患者对靶向治疗的临床反应。
图注:肺癌类器官样本的基因组分析。(来源:Wang, H., et al. 2023)
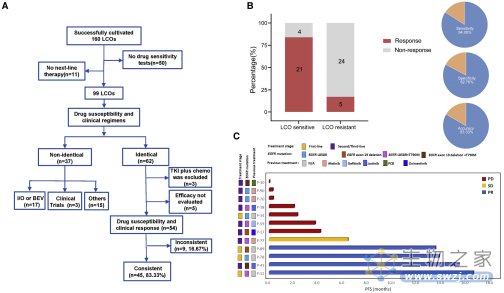
为了验证肿瘤类器官药物反应的实验稳定性和异质性,研究人员在同一患者上验证了在不同采样时间获得的肿瘤类器官基因组图谱高度一致(图A),验证了组织样本、积液样本和肿瘤类器官的基因组图谱的一致性(图B)
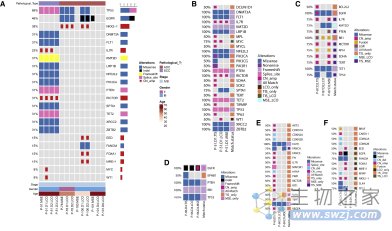
图注:肺癌类器官样本的稳定性和异质性。(来源:Wang, H., et al. 2023)
本研究中纳入了两例晚期肺腺癌双靶向基因变异患者:编号60的患者被诊断为IVB期肺腺癌(图A),基线时脑脊液中检测到EGFR L858R突变和MET拷贝数增加(5.0)。编号61的患者被诊断为IVA期肺腺癌(图F),基线时检测到EGFR 19del。
相比于单一靶向药物,两例患者的LCO-DST结果均显示联合靶向治疗(奥希替尼+赛沃替尼/卡博替尼)的肿瘤控制率更高,且临床中证实双靶联合治疗均达到了部分缓解(PR)。这些病例表明,LCO-DST可以很好地预测有效的联合治疗方案。
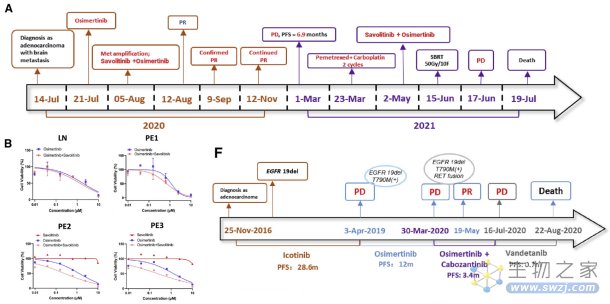
图注:肺癌类器官预测耐药病例的双靶向治疗。(来源:Wang, H., et al. 2023)
为了研究EGFR和RET抑制剂联合治疗的潜在分子机制,研究人员进行了4D无标记高通量蛋白质组学分析。主成分分析(PCA)的结果表明,不同治疗组的表达水平不同,即治疗效果不同。三个处理组均表现出相同的蛋白表达趋势,且核蛋白变化的数量最多,其次是细胞质和细胞膜蛋白。表明所有这三种治疗的蛋白质表达改变主要在于调节细胞核的功能,包括基因表达。
综合这些分析,可见药物敏感性与临床反应的总体一致性可达83.33%,LCO-DST在预测晚期癌症治疗反应中有极高的准确性,其在精确医学中具有巨大的潜力,后续可进行大规模临床试验,确定不同类型疗法的精确截止值。
个性化抗癌药物离不开人们对于基因突变的了解,而药物的疗效离不开准确的药物敏感性测试。癌症治疗是极其复杂的,不过科学家们也在不断开发新技术来实现越来越好的治疗策略。
参考来源:
Wang, Han-Min, et al. "Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: A real-world study." Cell Reports Medicine (2023): 100911.































