
人可以长命百岁,但人体细胞却很难做到,人体大部分细胞需要不断更新,它们大约每6-7年会更新一遍。然而,神经细胞是个例外,它们难以再生或复制,只能日复一日,年复一年,不知疲倦地工作,并根据环境变化不断重塑自己,维持大脑的正常功能。
这也引发了一个问题——神经元如何在数十年的漫长岁月中持续执行高强度工作并同时保持健康的?其“劳模秘诀”究竟是什么?
近日,哈佛大学医学院的研究人员在 Nature 期刊发表了题为:A NPAS4-NuA4 complex couples synaptic activity to DNA repair 的研究论文【1】。
研究团队发现了一种只存在于神经元中的全新的DNA修复机制,一种名为NPAS4-NuA4的蛋白质复合物启动了一条修复由神经元活动诱导的DNA断裂的途径,这一发现有助于解释为什么神经元可以超长工作而不受DNA突变的影响,帮助科学家了解大脑神经元在衰老或神经退行性疾病中消亡的精确过程。

神经元活动对于突触重构和记忆形成等一系列大脑功能至关重要。然而,这些细胞活动也会威胁神经元的基因组稳定性,例如代谢活性氧(ROS)增加导致DNA损伤,转录活性上调引起更多的DNA断裂。
尽管在各种细胞类型中都观察到类似的现象,但DNA突变在神经元中尤为棘手,因为神经元作为长寿细胞,不能使用依赖复制的DNA修复途径,并且具有有限的再生机制来替换受损细胞。
这造就一个十分矛盾的现象——神经元活动对神经元的性能和生存至关重要,但又对DNA具有固有的破坏性。对此,研究团队推测神经元很可能具有一种特殊甚至是专属的基因组保护机制,使它们能够在细胞活动增强期间承受长达数十年的DNA损伤刺激。
在这项最新研究中,研究团队将注意力转向一种名为NPAS4的转录因子。NPAS4在神经元中高度特异性表达,响应由感官体验变化驱动的神经元活动增强,调节活动依赖基因的表达,以控制兴奋性神经元对外界刺激的反应抑制。这也提出了一种新的疑问——为什么神经元有这种其他细胞类型中不存在的额外转录因子?
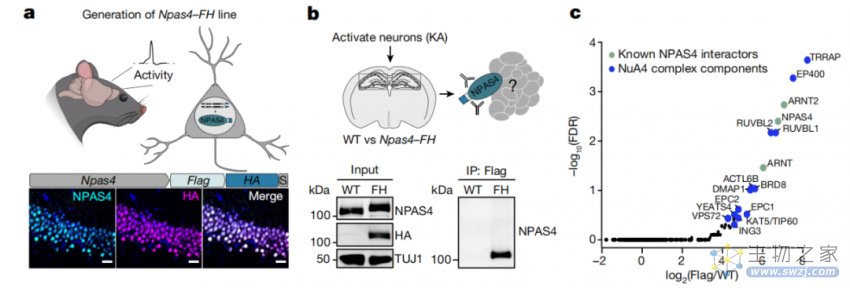
神经元活动促使在染色质上组装NPAS4-NuA4复合物
研究团队在小鼠身上进行了一系列以NPAS4为研究核心的生化和基因组实验。首先,他们确定NPAS4是由21种不同蛋白质组成的复合物的一部分,称为NPAS4-NuA4。紧接着,他们确定了该复合物与大量的神经元DNA损伤位点结合,并绘制了这些DNA损伤位点的图谱。
通过描述大脑中神经元活动诱导的DNA双链断裂的景观,研究团队证明NPAS4-NuA4与周期性受损的转录调控元件结合,并招募额外的DNA修复机制来刺激它们的修复。简而言之,NPAS4-NuA4复合物结合基因调控元件,防止年龄依赖性的体细胞突变积累。
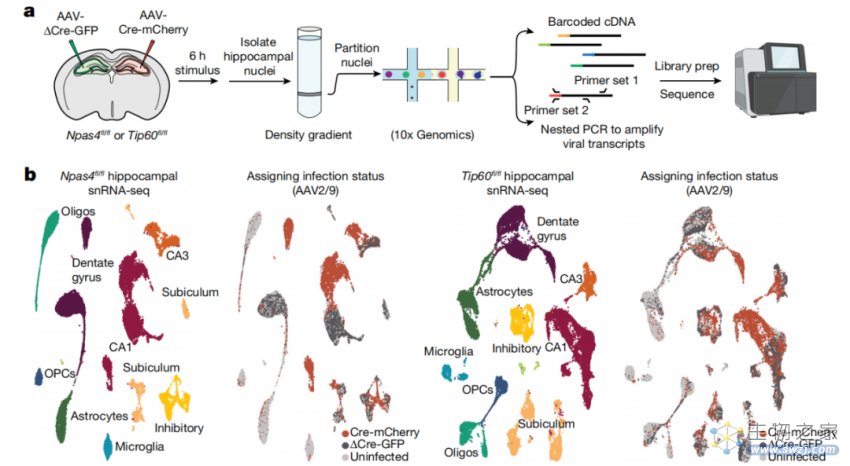
NPAS4-NuA4调节活性依赖的转录和体细胞抑制的招募
与此相印证,当NPAS4-NuA4复合物的组分被失活时,更少的修复因子被招募,神经元也发生了更多的DNA断裂。此外,存在NPAS4-NuA4复合物的DNA损伤位点比没有复合物的位点积累突变的速度更慢,神经元中缺乏该复合物的小鼠的寿命显著缩短。
这些结果表明,受损的NPAS4-NuA4复合物会导致一系列细胞缺陷,包括神经元活动依赖的转录反应失调、对神经元抑制的失控和基因组不稳定,最终导致实验小鼠寿命的缩短。
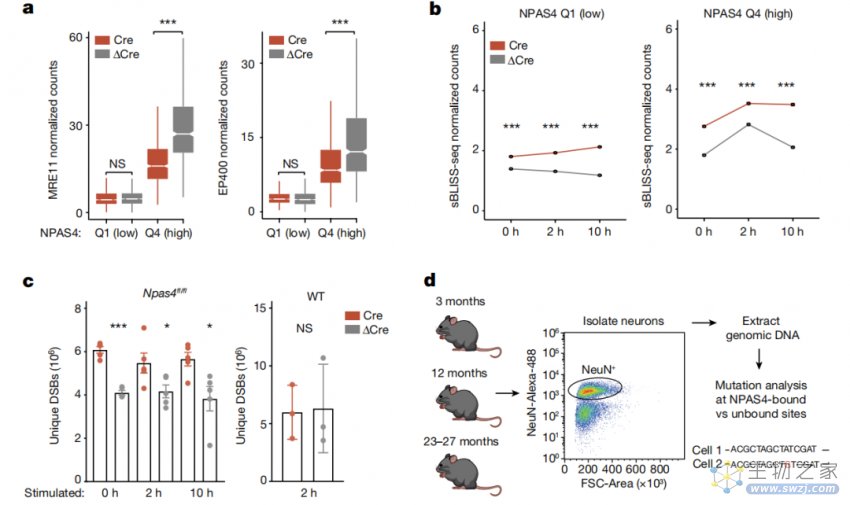
NPAS4-NuA4复合物的失活会损害基因组的稳定性,并缩短小鼠寿命
论文通讯作者 Michael Greenberg 教授表示,计划下一步在人类神经元中确定这种机制的存在。事实上,鉴于人类大脑的神经活动更为活跃,这种机制在人脑中可能更为普遍。有趣的是,此前已有研究证明,NuA4复合物的几种组分的突变会导致神经发育和自闭症。
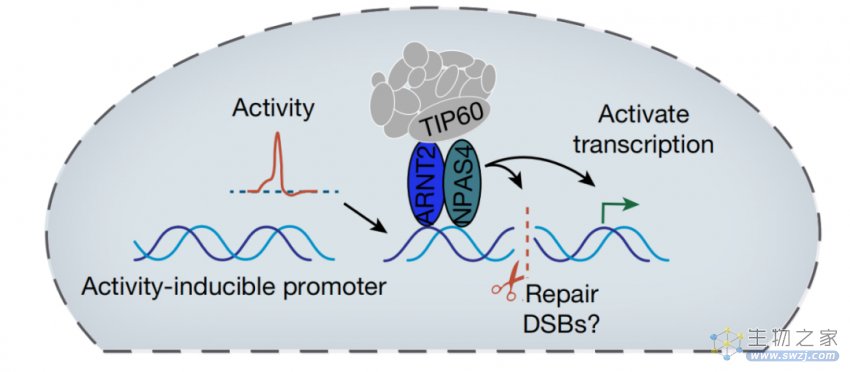
研究模式图
总而言之,这项研究发现了一种全新的DNA修复途径,这种修复机制由NPAS4-NuA4复合物介导,并且只发生在神经元中。这一发现将有助于我们深入了解神经发育障碍、神经退行性疾病和自闭症等神经疾病的发病原因,并以此开发潜在的治疗方法。
论文链接:https://www.nature.com/articles/s41586-023-05711-7































