脊髓性肌肉萎缩症 (Spinal muscular atrophy, SMA) 是一种渐进性运动神经元疾病,也是导致婴儿死亡的主要遗传原因【1】。SMA由生存运动神经元1(Survival motor neuron 1, SMN1)基因的纯合缺失或突变引起。但是一个或多个几乎相同(> 99.9%的序列相似性,实际上SMN1和SMN2仅有5个核苷酸不同)的SMN2基因可以部分补偿SMN1的缺失造成的缺陷【1, 2】,然而,SMN2基因中的一个C核苷酸改变成了T核苷酸,这导致其外显子7在转录过程中被跳过【3】。这个外显子缺失导致了SMN2基因所产生的蛋白质结构不稳定,并且缺乏功能,不能正确地执行其生物学作用。这种缺陷的蛋白质会被快速裂解,这就是为什么SMN2基因无法完全弥补SMN1基因的损失。由于这个核苷酸改变,SMN2基因的表达量和功能受到严重的限制,这是导致脊髓肌肉萎缩症的一个重要因素。目前,未经治疗的最常见的SMA(I型)患者的存活中位数仅为6个月。
上调SMN蛋白质可以拯救运动功能并显著改善SMA患者的预后。近年来,出现了多种治疗方法,可以通过上调SMN蛋白质来缓解SMA表型并改善生存期。但这些治疗的局限性在于在早期时间点和受损组织中SMN蛋白质的部分恢复可能是不足的。而且,由于这些治疗的短暂性必须要在患者的整个生命中反复使用昂贵的药物。
近日,来自David Liu实验室在Science上发表了题为Base editing rescue of spinal muscular atrophy in cells and in mice,介绍了单碱基编辑改变SMN基因方法可永久恢复SMN蛋白质水平并拯救SMA表型。研究团队使用核酸酶或碱基编辑器来修改五个SMN2调控区域,将SMN2的T6>C转换,将SMN蛋白质水平恢复到野生型。该方法在小鼠实验中取得了成功,平均寿命延长,运动功能得到改善。这些发现证明了一次性碱基编辑治疗SMA的潜力。

本文主要介绍了三种基因编辑策略,共79种具体方法来实现基因编辑。其中一种策略是通过删除位于ISS-N1区域的hnRNP A1/A2结合位点,提高SMN2中exon 7的转录率,进而提高SMN蛋白水平;另一种策略是通过破坏exon 8的后翻译调控序列来增加SMN蛋白的稳定性。此外,还可以使用BE-Hive预测模型,结合不同的碱基编辑酶和指导RNA,设计多种策略来修饰外显子7的调节原件。
首先,外显子7的转录受到下游内含子剪接沉默子ISS-N1的强烈影响,其中含有两个异质核糖核蛋白(hnRNP)A1 / A2结合位点。在3'hnRNP A1 / A2结合域内和下游的删除可以改善外显子7的转录。通过Cas9核酸酶介导的ISS-N1基因组位点的破坏可能会增加SMN2剪接中外显子7的转录,从而增加SMN蛋白水平。为了实现这一点作者使用了机器学习模型InDelphi来预测在ISS-N1区域进行编辑后的效果,并选择了9种不同的编辑策略进行实验。实验结果表明,所有高效率(≥85%)的编辑策略都显著提高了exon 7的包含率,使SMN蛋白水平增加了17倍至13倍。这项研究表明,通过编辑ISS-N1基因区域可以稳定地增加SMA患者中SMN蛋白的表达,从而提高SMA患者的治疗效果。
其次,完整长度的SMN和不稳定的SMNΔ7蛋白之间的关键差异在于,由外显子7编码的16个氨基酸被EMLA代替,EMLA是由外显子8编码的四个残基的降解信号。将外显子8的编码序列扩展五个或更多异源氨基酸会掩盖SMNΔ7 C端的降解信号。这些修改后的SMNΔ7(SMNΔ7mod)蛋白变异体具有增加的稳定性,并且可以挽救严重SMA小鼠的生存和运动表型。于是研究人员设计了Cas核酸酶介导的外显子8破坏策略,以生成类似的稳定SMNΔ7mod蛋白,不同的策略可以不同程度地增加SMN蛋白的水平,最高达17倍。
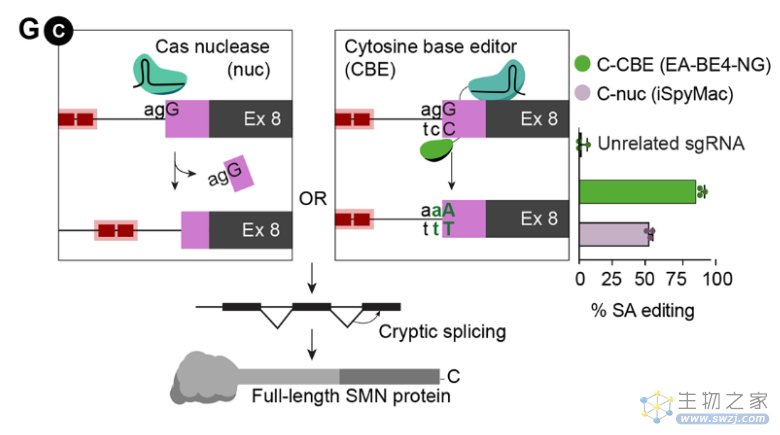
图1:核酸酶和CBE编辑策略,以及在外显子8处破坏3'剪切受体位点的基因组编辑结果
最后,SMN2的外显子7中的几个单核苷酸替换强烈调控其剪接,包括在位置6的C到T的转换(C6T),这将SMN1(C)和SMN2(T)基因区分开来,以及在外显子7末端的T44C、G52A和A54G。利用现有和新开发的BE-Hive碱基编辑结果预测模型,作者确定了42种策略(碱基编辑酶和引导RNA的组合)来修改外显子7的剪接调控元件(SREs),还验证了这些策略在小鼠胚胎干细胞中的有效性。总之,使用不同的Cas9变体和编辑策略可以高效地实现SMN2的单核苷酸编辑,并且基于BE-Hive预测模型的编辑结果与实际结果高度吻合。其中针对C6T的策略在实现高效编辑的同时,可以保持高度精准的编辑质量,这可能有助于治疗SMA等相关疾病。
鉴于SMA患者通常有多个SMN2拷贝,核酸酸测序和蛋白质质谱分析表明,ABE 8e编辑后,细胞内的其他基因组区域不受影响,与未编辑细胞的表型相似,这表明ABE 8e是一种高度特异性的基因编辑方法,可以在不干扰细胞正常功能的情况下实现精确编辑。在in vivo实验中,作者使用小鼠SMA模型测试了ABE 8e的疗效,并观察到SMN2蛋白的显著上调,从而改善了小鼠的生存率和运动功能,联合疗法效果则更为显著。这些发现表明,ABE 8e可能是未来治疗SMA的一个有前途的选择。
值得注意的是,虽然基因编辑技术为治疗SMA提供了新的途径,但其安全性和可行性仍需进一步评估。对于基因编辑技术的潜在风险,需要仔细评估其在治疗中的使用情况,特别是在临床应用中可能面临的安全问题。此外,需要确保编辑后的细胞和组织的长期稳定性,以及编辑后细胞和组织的安全性和功能性。因此,在将基因编辑技术用于SMA治疗之前,需要进行广泛的实验和临床研究以评估其安全性和有效性。
原文链接:www.science.org/doi/10.1126/science.adg6518
参考文献
1 Sugarman, E. A. et al. Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens. European journal of human genetics : EJHG 20, 27-32 (2012).
2 Boda, B. et al. Survival motor neuron SMN1 and SMN2 gene promoters: identical sequences and differential expression in neurons and non-neuronal cells. European journal of human genetics : EJHG 12, 729-737 (2004).
3 Lorson, C. L., Hahnen, E., Androphy, E. J. & Wirth, B. A single nucleotide in the SMN gene regulates splicing and is responsible for spinal muscular atrophy. Proceedings of the National Academy of Sciences of the United States of America 96, 6307-6311 (1999).































