近年来,伴随着免疫疗法的出现和应用,改变了很多癌症治疗的局面。然而,尽管已经取得了很大的成功,但免疫治疗的持久效应的实现仍然局限在小部分患者中。为了改善和突破这个限制,我们需要更好地理解免疫治疗的分子机制并确定治疗反应的预测指标。已有研究中,治疗前和治疗中活检的单细胞特征为T细胞扩张的模式提供了思路,但这也仅限于易于活检的癌症类型 (如黑色素瘤) 中的少量患者。双特异性T细胞衔接器 (Bispecific T cell engagers,TCEs) 的出现很好的解决了这个问题,它通过连接两个识别TAAs和T细胞表面上不同表位的抗体片段来克服与靶向肿瘤相关抗原(TAAs) 相关的一些挑战。目前为止,TCEs已经在各种癌症的治疗中初见曙,但对其原发性和获得性耐药的免疫机制和分子决定因素仍然知之甚少。
近期,加拿大卡尔加利大学的Nizar J. Bahlis课题组和德国海德堡大学医院的Marc-Steffen Raab在Cancer Cell发表了题为The pre-existing T cell landscape determines the response to bispecific T cell engagers in multiple myeloma patients的研究论文。他们通过研究确定了骨髓T细胞在接受BCMAxCD3 TCE治疗的多发性骨髓瘤患者中的保守行为。表明免疫组库对TCE治疗的反应是依赖于细胞状态的克隆扩增,并为通过主要组织相容性复合体I类 (MHC I类)、衰竭和临床反应来耦合肿瘤识别的机制提供了证据支持。此外,他们还发现大量衰竭的CD8+ T细胞克隆与临床反应失败有关,将靶表位和MHC I类的丢失描述为肿瘤对TCEs的内在适应。这些发现促进了我们对人体TCE治疗的体内机制的理解,并为预测免疫监测和调节免疫库提供了理论基础,以有助于指导未来恶性血液病的免疫治疗。

人体肿瘤T细胞浸润在功能状态和T细胞受体 (TCR) 介导的肿瘤细胞识别方面具有异质性。在血液系统恶性肿瘤中,如多发性骨髓瘤 (MM),由于高度紊乱和异质性的免疫组库在细胞类型组成、基因表达、克隆性和功能特性上的不同,对免疫治疗反应的决定因素的破译也会进一步复杂化。此外,免疫组库的可塑性还会进一步受到肿瘤负荷、疾病分期和治疗的影响。再加上个体患者的骨髓生态位在细胞组成和控制肿瘤生长的能力方面的差异。这些因素都会造成血液肿瘤的抗肿瘤反应的识别和免疫细胞检测的困难。
在几种癌症中,如黑色素瘤或肺癌,T细胞的克隆扩增驱动了对免疫检验点阻断(ICB)的治疗反应。目前,具有不同水平的衰竭标记的循环T细胞是否有助于治疗疗效或仅仅在免疫治疗中具有预测价值仍存在争议。在小鼠模型中,耗竭标记物高表达的T细胞似乎对ICB的再活力难以抑制。然而,在NSCLC患者中,表达高水平PD-1的功能失调T细胞的频率已证实与抗PD-1治疗的临床反应相关。其他耐药机制可能涉及肿瘤相关骨髓细胞、调节性T细胞 (tregs) 的免疫抑制,或抑制性免疫检验点的表达,以及导致肿瘤逃逸的肿瘤相关抗原的下调。
双特异性T细胞衔接器 (TCEs) 旨在通过连接两个识别TAAs和T细胞表面上不同表位的抗体片段来克服与靶向肿瘤相关抗原 (TAAs) 相关的一些挑战。TCEs通过连接T细胞和肿瘤细胞,触发了一系列导致T细胞激活和随后的肿瘤细胞裂解的事件。在多发性骨髓瘤中,TCEs达到较高的临床效果响应率。然而,耐药性也是不可避免,一些患者对TCE治疗无效,即使TCE靶抗原高表达。最近研究表明靶抗原缺失与获得性TCEs耐药有关,但尚不清楚是否存在原发性和获得性耐药的其他免疫机制。此外,鉴于一些患者发生了原发性反应失败,确定TCE反应的预测指标以指导治疗策略至关重要。
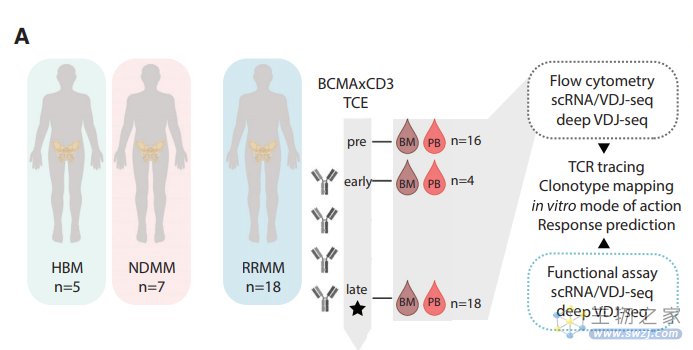
目前最常用的T细胞重定向双抗是针对肿瘤细胞表面表位以及T细胞上CD3受体的双特异性抗体,但对于人体骨髓和外周免疫系统如何与这些抗体进行交流和反应还尚不清楚。为了了解MM中TCE反应的分子机制,作者首先尝试描述骨髓常驻和外周T细胞库对TCE治疗的反应。他们分析了来自30名样本库,包括5名健康骨髓、7名新诊断MM患者和18名复发/难治性MM (RRMM) 患者在接受BCMAxCD3双特异性抗体单药治疗后的骨髓相关免疫细胞的转录组和TCR库。通过将T细胞克隆的TCR氨基酸序列作为个体条形码,追踪它们的时间,进一步将纵向数据与全球和个体库水平的分析整合在一起。经过严格的质量控制和筛选,他们从5个HBM、7个NDMM和18个RRMM捐赠者中获得了325,571个骨髓相关免疫细胞。接下来,作者对健康和患病骨髓细胞组成的整体变化进行了概述,包括MM的进化以及TCE治疗。发现与NDMM患者相比,RRMM患者没有表现出Treg数量增加,但CD8+ T细胞数量增加。此外,病变骨髓中CD4+ T细胞丰度降低,这都导致RRMM患者CD4+/CD8+比值降低。进一步研究发现,与NDMM患者相比,RRMM患者CD8+细胞绝对计数的增加是由于克隆性的增加。RRMM患者骨髓中细胞毒性标志物(PRF1、GZMB)和TCF-1 (TCF7)的表达显著降低,衰竭标志物PDCD1和LAG3与命运调节因子TOX的共表达显著降低。接下来,作者利用治疗前和治疗中可用的配对数据,分析了16名TCE治疗患者的骨髓TCR库,并观察到在治疗过程中整体克隆性的显著增加,而克隆型的绝对数量在采样时间内没有显著差异。在TCE暴露下出现了更多高度扩张的克隆。重要的是,临床应答患者对TCEs表现出显著的克隆扩增反应,这与之前调查对ICB反应模式的研究一致,其中绝对克隆扩增与临床反应相关。这些研究表明骨髓相关T细胞组库响应了cd3靶向免疫治疗与克隆扩增。
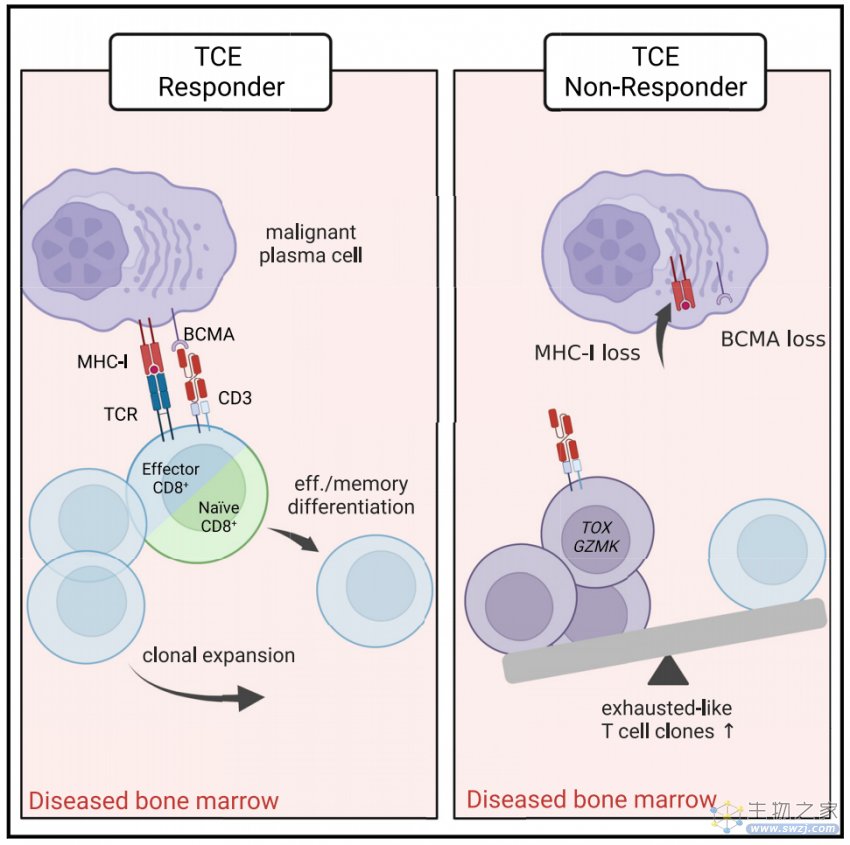
接下来,作者通过比较TCE暴露前后每个T细胞簇的比例,发现CD4_memory_LTB T细胞比例显著下降。相比之下,CD8_effector_CX3CR1显著增加。总体稳定的骨髓TCR库对TCE暴露的一些T细胞亚群的克隆变化作出反应。而CD8+ T细胞的克隆出现了显著的克隆变化。研究结果显示相关克隆扩增的单个TCR克隆在CD8_effector_CX3CR1 T细胞中显著富集。并且在治疗后的效应细胞和记忆细胞簇中发现了最初的native CD8+ T克隆,而最初的native T细胞在记忆和Treg状态中富集。与最终分化的CD8+ T细胞克隆相比,在治疗开始前大部分为native CD8+ T细胞克隆,随着时间的推移,转录组距离显著增加。这可能导致初始T native细胞克隆的子代细胞在治疗后被分配到多个转录簇。表明,TCE反应由CD8+效应细胞驱动。进一步研究发现,大多数CD8_effector_CX3CR1大克隆在整个治疗过程中持续存在,这与它们明显的克隆扩增一致。值得一提的是,在整个治疗过程中仍然检测到很大一部分CD8_exhausted-like_TOX克隆型。这表明预测标志物是特异性的主动免疫疗法,如双特异性TCEs。类T细胞克隆的丰度的耗尽与临床反应失败有关。
最后,为了破译TCEs的免疫作用模式,作者在体外骨髓共培养了原代人骨髓来源的T细胞和从使用BCMAxCD3功能性TCEs治疗的RRMM患者中分离的自体恶性浆细胞。通过一系列的实验和分析,发现并证明了双特异性TCE治疗多发性骨髓瘤的两种作用模式:刺激时特异性转录定义的T细胞克隆的优先扩增,以及分化和MHC I类依赖的原始T细胞启动。相应地,作者将MHC受体分子的丢失描述为TCE介导的肿瘤免疫逃逸超越靶抗原丢失的潜在机制。利用这种机制,恶性细胞可能会逃脱MHC I类依赖的T细胞反应的额外免疫压力。表明MHC class I:TCR共信号会放大TCEs对CD8+ T细胞的激活。
总的来说,本研究通过对骨髓T细胞库及其对TCE治疗产生的扰动的反应进行了全面的纵向分析,并使用从人类患者分离的原代细胞整合了额外的实验数据,以描述TCE的分子作用模式。这些研究结果确定了骨髓中CD4+和CD8+ T细胞在接受TCE治疗的MM患者中的保守行为,并建立了T细胞状态和肿瘤识别作为非实体肿瘤中克隆T细胞扩增和临床反应的先决条件。
原文链接:
https://doi.org/10.1016/j.ccell.2023.02.008































