阿尔茨海默病是一种常见的神经退行性疾病。据世卫组织统计,目前世界范围有超 5500 名患者,预计到 2050 年患者数量可能增加到 1.4 亿人,然而现阶段临床方面依然没有特效药物。针对其发病机制,医学界公认的有 tau 蛋白假说和 β-淀粉样蛋白假说,均与体内蛋白质异常有关。因此,探索蛋白质作用机制有望为阿尔茨海默病等疾病的治疗提供新策略。
作为体内最重要的生物大分子,蛋白质是由不同氨基酸首尾相连缩合而成的多聚体。每种蛋白质均有自身独特的三维空间结构(蛋白质构象),这也是蛋白质发挥生物学功能的基础。在分子水平解析蛋白质作用机制需要测定其三维空间结构,常用的分析手段包括 X 射线晶体学、核磁共振以及冷冻电镜等技术。

(来源:Cell)
近日,来自哥伦比亚大学、纽约大学格罗斯曼医学院、杜克大学医学中心的研究人员组成的联合团队,通过冷冻电子显微镜解析了一种关键蛋白 LRP2 的三维结构,并揭示了该蛋白作为一种“分子机器”能够在细胞膜表面结合配体并在核内体中脱落配体,为蛋白相关疾病的治疗提供新见解。目前,这项研究已经以“Structures of LRP2 reveal a molecular machine for endocytosis”(LRP2 的结构揭示了内吞作用的分子机制)为题发表在 Cell 期刊上。
“我们的这项发现为进一步研究低密度脂蛋白受体的功能和机制提供了理论基础,相信随着对这种关键蛋白质的新机制的理解,以及探索如何阻断其突变,将有望发现治疗肾脏和大脑疾病的新靶点。”该论文共同通讯作者、哥伦比亚大学瓦格洛斯医师学院病理学和细胞生物学教授 Jonathan Barasch 博士表示。

▲图|哥伦比亚大学瓦格洛斯医师学院病理学和细胞生物学教授 Jonathan Barasch 博士(来源:Columbia University)
Jonathan Barasch 博士是泌尿科和肾脏科临床医生,除了在哥伦比亚大学担任教授,他还是哥伦比亚长老会医疗中心的住院医师以及哥伦比亚大学欧文医学中心的研究员,现阶段他的研究方向包括肾功能衰竭和肾脏病理学等领域。
01
研究:采用冷冻电镜解析蛋白质三维结构
在 Jonathan Barasch 看来,高分辨率的蛋白质结构解析将为很多疾病的发病机制和治疗方法提供新的线索,比如急性肾损伤、慢性肾病、阿尔茨海默病,以及一种名为“Donnai-Barrow”综合征的具有多种身体和认知后果的罕见遗传性疾病。而此次他和团队的这项研究将目光锁定在一种名为“LRP2”的蛋白质。
LRP2 蛋白:低密度脂蛋白受体相关蛋白 2(LRP2),是一种细胞表面蛋白,属于内吞性受体并在内吞作用中发挥作用,先前的研究发现其与肾脏和大脑疾病存在密切关联。
作为 LRP 蛋白家族的一个重要成员,LRP2 存在于从蠕虫到人类的各种生物体内。其最早发现于上世纪 80 年代初期。相较于细胞膜上的大多数蛋白质,LRP 非常庞大,因此又被称为“巨蛋白”。
在肾脏内,肾细胞从体液中过滤后的代谢废物中回收可重复使用的分子,LRP2 蛋白在这个过程中发挥至关重要的作用,每个肾细胞表面拥有数以万计的 LRP2 蛋白,类似于分布在草莓表面的种子一样。“肾脏需要过滤和回收来自身体代谢产生的大约 99% 的盐分和水分,以及回收 100% 的小分子蛋白质,否则这些蛋白质会进入尿液并排出体外。” Jonathan Barasch 说道。
然而,想要解析 LRP2 蛋白并不是一件容易的事情,先前的研究发现包括 LRP2 在内的 LRP 家族的这类膜蛋白难以分离,而想要详细绘制其三维结构更是困难重重。
对此,该论文的第一作者、哥伦比亚大学瓦格洛斯医师学院生物化学和肾病学教授 Andrew Beenken 博士通过一系列生化技术克服了这一挑战。他和团队从 500 个小鼠肾脏中获取了足够多的 LRP2 蛋白,然后将蛋白质固化成足够大小和纯度的样本,以便借助显微镜技术进行解析。
“起初,我认为这是不可能实现的。”该论文共同通讯作者、哥伦比亚大学祖克曼心脑行为研究所研究员、瓦格洛斯医师学院教授 Lawrence Shapiro 博士说道,“我主要从事蛋白质的复杂结构如何产生其生物学功能方面的研究,而我们的这项研究将是探索 LRP2 蛋白分子的作用机制的关键步骤。”
值得一提的是,在 LRP2 的收集过程中,他们捕获并锁定了 LRP2 蛋白分子的两个关键构象 。“这种细微结构是揭示该蛋白分子在细胞中发挥作用的重要细节。”Andrew Beenken 指出。
有了样品,采用何种工具进行分析成为关键。该论文共同通讯作者、哥伦比亚大学祖克曼心脑行为研究所研究员、瓦格洛斯医师学院教授 Anthony Fitzpatrick 博士专注于低温电子显微镜(Cryo-EM)领域,在他看来,“Cryo-EM 特别适合研究大型蛋白质以及各种生物分子。”
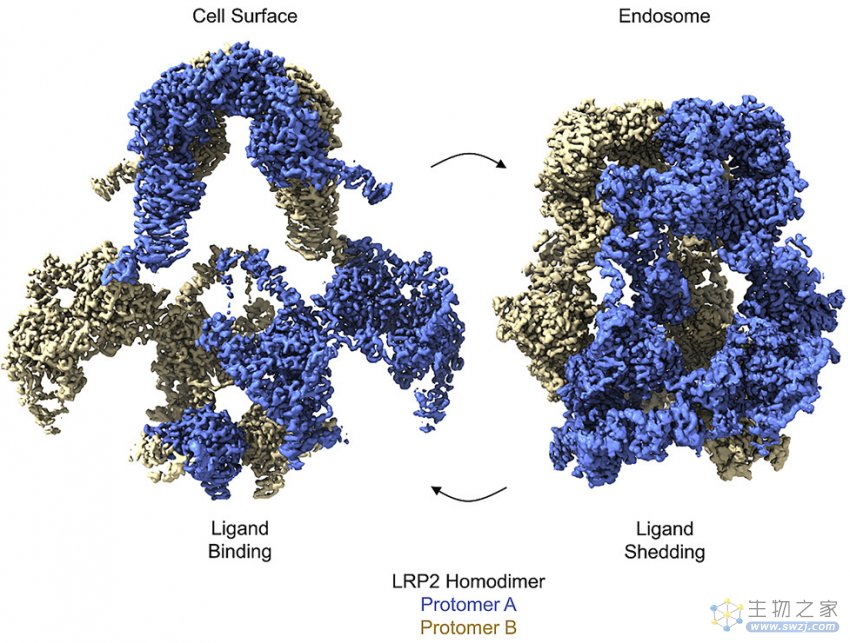
▲图|基于冷冻电子显微镜解析的 LRP2 蛋白构象(来源:Cell)
在这项研究中,他们基于从小鼠中获得的 LRP2 蛋白分子样本、借助液氮冷却的低温电子显微镜采集了大量的结构数据。随后,他们通过强大的计算工具对这些数据进行解析,最终生成了接近原子细节的三维蛋白质结构。
“我们获得了有史以来最为详细和清晰的 LRP2 蛋白三维结构图谱。”Lawrence Shapiro 说道,“基于这些三维结构图谱,我们接下来就可以开始梳理和分析 LRP2 蛋白在细胞中发挥作用的独特机制。”他补充说。
02
发现:LRP2 通过构象转换实现配体的结合与脱落
他们通过研究发现,LRP2 蛋白存在两种构象。其中一种是 LRP2 驻留在细胞膜上和细胞膜内时的构象,此时蛋白质从细胞外的液体中吸收配体,包括从肾脏产生的尿液以及脑细胞周围的液体。
据论文介绍,这些配体包含一些小蛋白质,比如 tau 蛋白和 β-淀粉样蛋白(均为与阿尔茨海默病有关的蛋白)、胰岛素,以及在细胞中“吞吐”维生素 A 和 D 的蛋白质等。
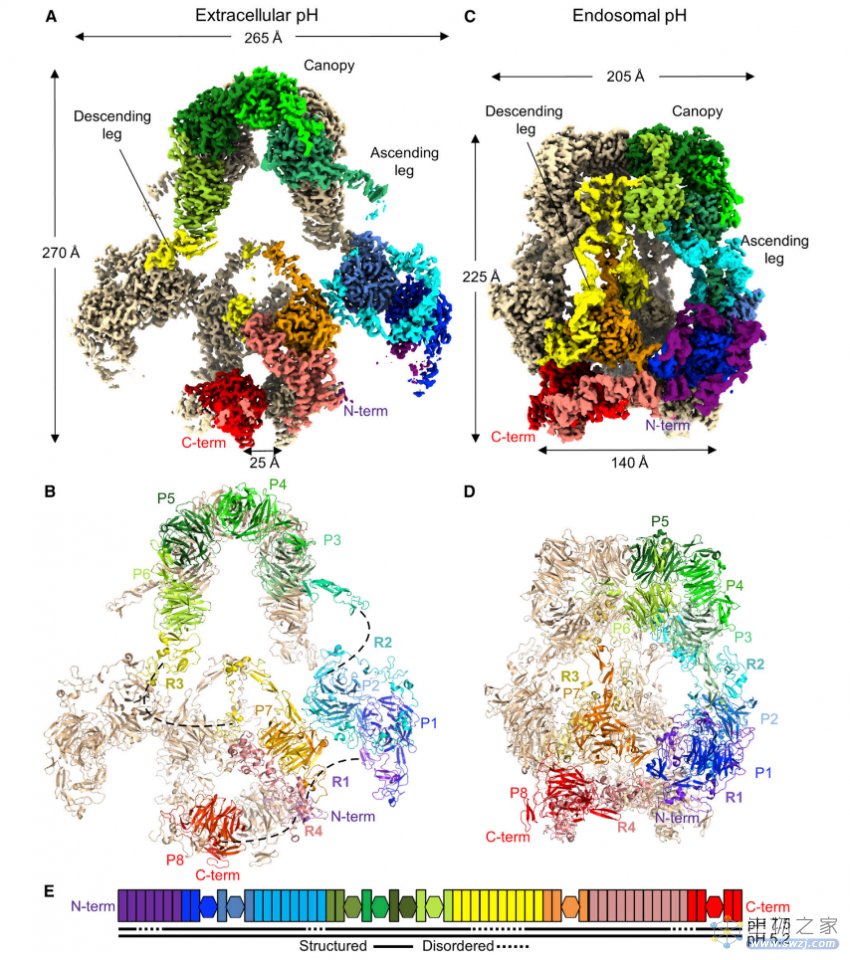
▲图|细胞外和核内体的 LRP2 同型二聚体结构(来源:Cell)
另外一种是 LRP2 被包裹在一层细胞膜中并运送到细胞内时的构象。LRP2 在细胞膜包裹的囊泡结构中,该构象的蛋白可以使配体完整地释放回收以供生物体进一步利用,并且也可以分解成可重复使用或一次性使用的“部件”。
基于对蛋白分子结构的细节解析,他们发现, LRP2 蛋白是通过构象的变换实现了对于分子配体的“吸收与释放”。
当 LRP2 蛋白正常时,它们可以成功地维持血液和大脑组织中的分子平衡,但是当 LRP2 的分子结构发生微小的变化时,这些蛋白质就会诱发多种疾病。
比如,在肾细胞中,有缺陷的 LRP2 蛋白无法回收尿液中的蛋白质,而这就可能导致包括慢性肾病、Donnai-Barrow 综合征等在内的多种疾病;在大脑中,LRP2(以及相关的 LRP1)通常有助于清除多种毒素,其中包括长期以来与阿尔茨海默病相关的 tau 蛋白片段,但 LRP 家族蛋白出现异常可能促进该病发展进程。
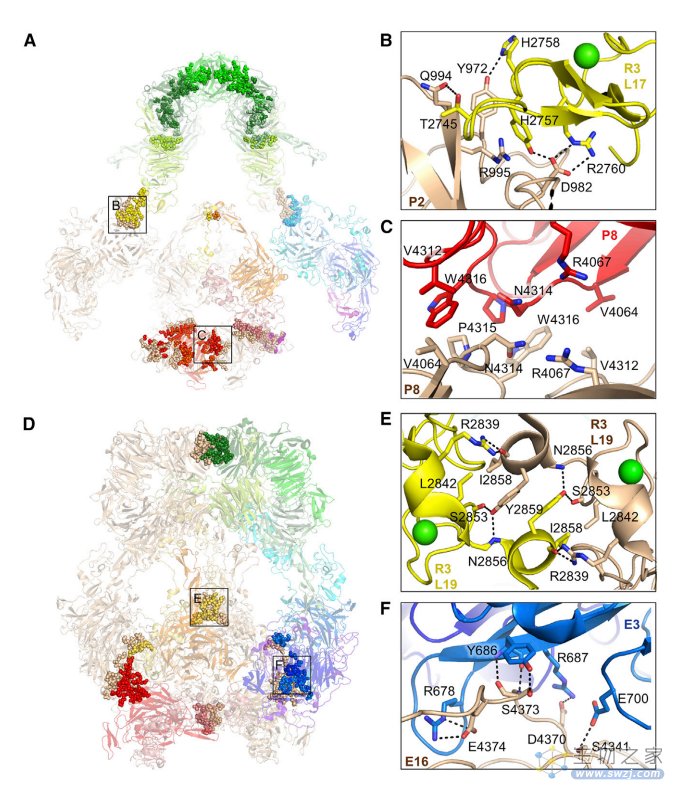
▲图|LRP2 同型二聚体界面调节配体结合(来源:Cell)
“因此,通过药物抑制这种情况的发生,就可能会对疾病的治疗带来帮助。”Lawrence Shapiro 指出。
“对于阿尔茨海默病而言,如果能够确切知道 tau 蛋白结合位置分子结构细节,那么就可以使用抗体或小分子来阻断进程。而借助低温电子显微镜可以让我们达到所需要的分子细节水平,以便研究潜在的新疗法。”Anthony Fitzpatrick 补充说。
“我们的这项研究,是发现 LRP2 蛋白和 LRP 蛋白家族的分子作用机制,以及针对一系列相关疾病发现新药物靶点的漫长道路的开始。”Andrew Beenken 说。
总而言之,这项研究基于冷冻电子显微镜展示了从小鼠肾脏分离的 LRP2 蛋白分子在细胞外和胞膜包裹的囊泡的三维结构,不同的结构表明 LRP2 是一种“分子机器”,其一种构象在细胞表面结合配体,另一种构象在核内体中脱落配体,LRP2 蛋白构象转换受同源二聚体和原聚体内界面上的 pH 敏感位点控制。
如今,包括冷冻电子显微镜等解析技术的进步为结构生物学的发展提供了得力工具,随着对蛋白质分子功能机制的深入研究,越来越多的“细节”将会被发现,治疗药物的开发也将“有靶可依”,相信不久的将来,包括阿尔茨海默病等在内的多种疾病也不再是难治之症。
参考资料:
1.https://doi.org/10.1016/j.cell.2023.01.016
2.https://phys.org/news/2023-02-key-protein-kidney-brain-avenues.html
3.https://www.pathology.columbia.edu/profile/jonathan-m-barasch-md































