近日,一家美国眼科疾病基因治疗初创公司 Vedere Bio II 宣布,由于在临床前试验中未达到预定的试验标准,公司经综合考虑,决定停止运营。
Vedere Bio II 董事长、Atlas Venture 合伙人 Kevin Bitterman,以及公司 CEO Cyrus Mozayeni 写道,我们为治疗方法设定了比较高的标准,并进行了大量临床前疗效研究,以确定是否能够突破了这一标准。基于目前已经获得的研究结果,我们做出了停止运营的艰难决定。
这是一家成立将近 2 年的生物技术公司,总部位于马萨诸塞州剑桥,专注于通过光遗传学方式开发眼科基因疗法。2021 年 5 月正式亮相的同时,该公司宣布获得了 Atlas Venture、Mission BioCapital 和 Foundation Fighting Blindness 等投资方参与的 7700 万美元融资。2020 年 9 月,其前身 Vedere Bio 被诺华收购,预付款为 1.5 美元,后续的里程碑款项为 1.3 亿美元。

(来源:Vedere Bio II 官网)
Kevin Bitterman 与 Cyrus Mozayeni 也在声明中提到,团队成员相信基于试验数据做出的这一决定符合患者和投资人的利益。
值得一提的是,诺华的发言人在给外媒的邮件中表示,诺华当下仍在推进 2020 年从 Vedere Bio 收购的临床前基因治疗候选管线和技术,在研产品正处于临床前开发阶段。
01
UCB 教授联创,前身成立 1 年即被诺华收购
Vedere Bio 成立于 2019 年,专注于开发治疗不同类型失明的基因疗法,包括先天性失明和后天性失明。其底层科学技术建立在加州大学伯克利分校(UCB)Ehud Isacoff 和 John Flannery 实验室研究成果基础之上。
Ehud Isacoff 是 UCB 分子与细胞生物学系神经生物学教授、海伦·威尔斯神经科学研究所所长,他在神经元化学、电信号以及开发光学神经技术观察和远程调控脑细胞活动方面造诣颇深;John G. Flannery 是视光与视觉科学教授、分子与细胞生物学系神经生物学教授、海伦·威尔斯神经科学研究所副所长,他的研究方向主要集中在视网膜变性、AAV 基因治疗以及通过光遗传学方式用于视力恢复。

▲图 | 左为 John G. Flannery 教授,右为 Ehud Isacoff 教授(来源:UCB 官网)
2019 年,Ehud Isacoff 和 John G. Flannery 课题组合作将光敏蛋白受体基因递送到失明小鼠玻璃体液中,成功使失明小鼠 90% 的神经节细胞对光敏感,帮助失明小鼠恢复到了正常小鼠的水平。成立的初创公司 Vedere Bio 以此研究为基础,通过光遗传学方式恢复视网膜视力,具体的工作机制是将自然产生的光敏蛋白质通过 AAV 递送到特定的视网膜神经节细胞,刺激靶细胞感知信息并将信息传输到脑部的视觉处理中心。这种方法可以绕过视网膜变性中丧失功能的感光细胞让患者重新恢复视力,视网膜变性即眼球后部感光神经层的功能丧失。
这种恢复视力的方式引起了诺华的关注,其认为这种帮助小鼠重见光明的基因治疗方式很可能在由于遗传性视网膜疾病导致失明的患者身上也产生类似的效果。彼时,诺华投入大量资金布局基因治疗领域,并将 Vedere Bio 的这种治疗手段视为治疗遗传性视网膜营养不良(IRD)的一种潜在方法。
IRD 是一类遗传性视网膜疾病,其特征是感光细胞功能丧失和进行性视力丧失,遗传性强和具有高度临床异质性。此类疾病在全球范围内影响了超 200 万人,通常会导致完全失明。目前,已有超过 270 个基因与 IRD 相关,现有的治疗方式还比较有限。
(来源:Journal of Medical Genetics)
2020 年,诺华宣布以 2.8 亿美元收购成立仅仅一年的 Vedere Bio,预付款 1.5 亿美元,以及后续 1.3 亿美元的里程碑付款。根据收购协议,当时诺华收购了 Vedere Bio 的主要项目以及新型递送技术,包括 2 个处于临床前的光遗传学 AAV 基因治疗项目,递送到视网膜细胞中的光敏蛋白和注射玻璃体腔实现治疗的特有腺相关病毒 AAV 递送载体。
此外,还有一些技术并未包含在这项交易中。2021 年 5 月,原班领导团队和投资人基于这些技术和另一个不同的临床前管线重新组建了一家新公司 Vedere Bio II,当时,这家新成立的公司声称其治疗方法适用于“存在未满足需求的适应症”和“有望克服传统基因疗法的局限性”。该公司由 Atlas Venture 孵化,成立即获 Octagon Capital 领投、新投资方 Casdin Capital 参投,创始投资方 Atlas Venture 也持续押注,首轮融资募资7700 万美元。
后续,罕见病上市公司 BioMarin 基因治疗研究负责人 Gabor Veres 加入了 Vedere Bio II 并担任首席科学官,加入之后他负责 AAV 平台开发工作。
02
可靶向任何基因突变形式,曾表现出临床应用潜力
Vedere Bio II 定位是一家“下一代”眼科基因疗法初创公司,目标是为因感光细胞故障导致视力丧失的患者开发恢复和保持视力的新型基因疗法,不仅仅是减缓视力丧失。而目前大多数基因疗法都针对特定的基因突变且只能减缓视力丧失。
根据官方的介绍,这家公司的首选适应症是遗传性视网膜色素变性(RP)和地图样萎缩(GA)。RP 是遗传性视网膜疾病最常见的临床类型,这是一组复杂的遗传性营养不良,主要影响光感受器和色素上皮功能;GA 是干性年龄相关性黄斑变性(AMD)的一种晚期形式,会导致进行性和不可逆的视力丧失。
该公司计划基于“基因突变无关(mutation-agnostic)”光遗传学平台,开发不受特定遗传基因限制的遗传性视网膜色素变性和地图样萎缩的基因治疗方法。以遗传性视网膜色素变性为例,这种疾病由 50 多种基因突变引发,而该公司的方法适用于多种甚至所有突变形式的遗传性视网膜色素变性。
上文提到,诺华收购的临床前产品是依赖于 11-顺式-视黄醛(11-Cis-Retinal)的一次性基因治疗候选管线,通过在视网膜中递送表达光敏蛋白的基因发挥作用。而 Vedere Bio II 的治疗项目是一种基于 GPCR 的改进系统,包括注射到眼部的基因疗法和小分子药物两部分,官方声称这种治疗方法有潜力比之前的项目更高效恢复视力。
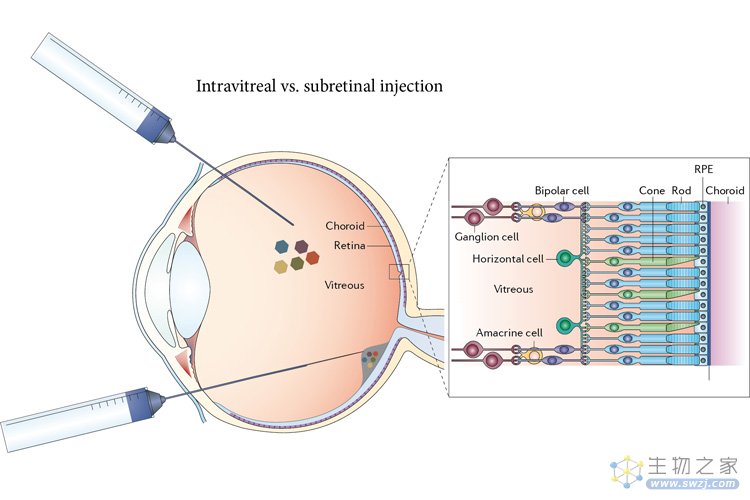
(来源:UCB 官网)
具体来说,基因疗法向眼部玻璃体液中递送一种可调节细胞功能并进行信号传导的 G 蛋白偶联受体(GPCR),其本身对光没有响应性;但是,当基因治疗与小分子化合物结合之后,基因治疗就会具有光响应性,小分子会充当光开关并根据光线改变形状,然后通过 GPCR 发出信号。这种方式不依赖于体内的光敏蛋白,比如说 11-顺式-视黄醛,因此这种方法可能对缺少这类型蛋白质的患者更有效。
Cyrus Mozayeni 指出,不同的小分子对不同波长的光做出反应,我们可以通过不断优化改进小分子优化治疗方式。此外,患者可以根据实际情况作出调整,停止或继续服用小分子。
最初,这种治疗方法也确实显示出了极具前景的临床应用潜力。Vedere Bio II 在 2022 年美国基因与细胞治疗协会年会上展示了其 AAV 衣壳的临床前数据,称这些 AAV 衣壳在视网膜中“具有很高的转染效率”。在视网膜色素变性小鼠模型中,公司的技术平台和疗法能够恢复视觉功能,帮助失明小鼠恢复到正常没有缺陷小鼠的视力水平。
Cyrus Mozayeni 表示,这些数据对于公司的科学来说是非常有希望的迹象。不仅提高了公司主导项目成功的可能性,而且还提高了建立管线和制备和生产高质量载体的能力。
当时,该公司表示会利用 A 轮融资推进主导产品申报 IND。不过,随着临床前试验的进一步推进,候选产品未达到预定的试验标准,管理团队做出关停公司的决定。
参考资料:
1.https://www.biopharmadive.com/news/vedere-bio-biotech-shut-down-optogenetics/646599/
2.https://www.reuters.com/article/us-vederebio-m-a-novartis-idUKKBN27E0QW
3.https://news.berkeley.edu/2019/03/15/with-single-gene-insertion-blind-mice-regain-sight/
4.https://www.prnewswire.com/news-releases/vedere-bio-ii-presents-positive-new-data-supporting-its-proprietary-platform-at-the-25th-annual-asgct-meeting-301550552.html































