
利用小鼠干细胞在细胞培养中获得或失去染色体的倾向的小鼠干细胞筛选已被用于将雄性XY细胞转化为雌性XX细胞。随后的分化产生功能性卵和活的后代。
多能干细胞自我补充和分化成身体任何细胞类型的能力为研究培养疾病和产生用于治疗的个性化细胞提供了机会。但是,在体外生长多能干细胞也伴随着危险,因为长时间的培养会导致异常,例如非整倍性,其中染色体被复制或完全丢失。作者表明可以利用这种非整倍性倾向将一种多能细胞 - 小鼠胚胎干细胞(mESCs) - 从雄性转化为雌性。作者引导性别转化的细胞形成可以受精产生后代的卵子,标志着生殖生物学的一个里程碑。
小鼠胚胎中卵子和精子的产生始于称为原始生殖细胞(PGC)的前体。PGCs向卵子或精子的初始分化并不取决于内在的性染色体,而是取决于来自周围性腺的性别特异性化学线索。然而,分化为成熟卵子或精子的最后阶段确实分别需要XX或XY性染色体。
小鼠卵子和精子也可以在体外由mESC产生。首先,衍生出PGC样细胞。细胞与胎儿卵巢或睾丸细胞(或体外产生的等效物)一起培养)6然后需要启动分化,并且需要内在性染色体来完成分化为成熟的卵子或精子。
村上等人着手从雄性细胞中产生卵子,这一成就将极大地扩展未来生育治疗的可能性。由于成熟卵子的产生需要XX染色体,因此作者设计了一种方法来寻找罕见的男性干细胞,这些干细胞会抛弃其Y染色体,然后复制其X染色体(图1)。
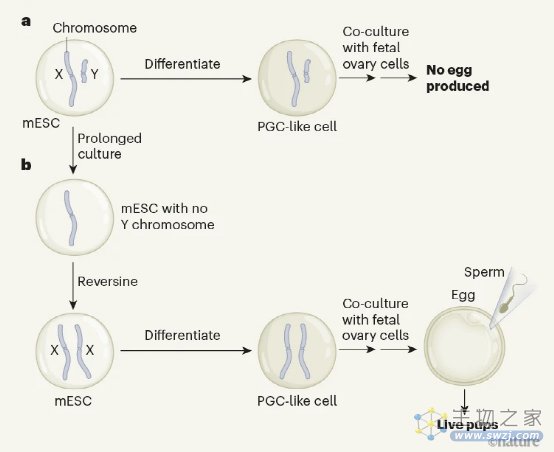
研究人员设计了mESCs,使其携带一种在其X染色体上编码红色荧光蛋白(DsRed)的基因,从而可以监测每个细胞中此类染色体的数量。然后,他们将雄性mESC培养八轮生长并重新铺入新鲜培养皿中 - 在这种情况下,细胞容易偶尔失去Y染色体。这种损失可以通过称为PCR的DNA扩增过程轻松检测到。作者发现,6%的细胞失去了Y染色体,形成了只有一条性染色体X(表示为XO细胞)的mESC。
作者继续生长XO细胞,筛选染色体重复。这些重复是由于错误的细胞分裂而出现的:在DNA复制后,相同的染色体集通常被分离成两个相同的子细胞,但是染色体的错误分离可能导致来自XO mESC的复制X的两个拷贝被分割成一个子,形成一个XX细胞。研究人员使用DsRed荧光的强度来区分XO和XX细胞。他们发现,用一种叫做逆转的药物处理细胞,这种药物抑制了细胞分裂中的一个关键检查点,增加了X重复的数量。
接下来,作者使用先前开发的协议将产生的XX mESC分化为PGC样细胞。他们添加了来自小鼠胎儿卵巢的细胞,这些细胞为PGC样细胞分化成卵子提供了信号,XX染色体使成熟。最后一步是通过野生型精子进行体外受精,从而产生可以转移到小鼠子宫中的胚胎,并产生可存活的后代。研究人员表明,可以通过触发诱导多能干细胞(iPSC)的体外性别转换来实现类似的结果 - 一种多能细胞,来源于分化细胞(在这种情况下,XY皮肤细胞),通过使用转录因子将其细胞身份重新编程为胚胎样状态。
并非所有非整倍性都涉及性染色体。例如,21号染色体的额外拷贝(称为21三体)导致人类唐氏综合症,而小鼠的16三体复制了这种情况的某些方面。在最后的实验中,村上及其同事表明,成熟的卵子不能从16 mESC三体中生长出来。然而,用逆转治疗16三体mESC可以促进额外16号染色体的丢失,而不会影响其他染色体。这恢复了细胞成熟成卵子的能力。
作者的方案为生殖生物学和生育研究开辟了新的途径。从XY皮肤细胞产生精子和卵子的能力 - 以及最终的后代 - 可能是快速产生近交小鼠品系的一种手段,与同卵双胞胎一样,它们为实验室实验提供了一致的遗传背景。此外,作者筛选失去染色体的细胞的策略可用于研究为什么某些染色体在ESC和癌细胞中的错误分离阈值低于其他染色体。染色体结构的某些方面(例如称为着丝粒的结构的位置)会影响错误分离的倾向,但这是否以及如何取决于细胞类型仍然未知。
然而,该协议有局限性,最明显的是效率低。尽管大约30%的转化mESC成熟为卵子,其中40%可以受精,但转移到代孕者的胚胎中只有1%是活生生的。目前尚不清楚导致这种低效率的限制是技术上的还是生物学上的。
重要的是,目前尚不清楚该协议是否适用于人类干细胞。尽管人类多能干细胞成功地分化为PGC样细胞,但随后对卵子的性别分化仍然不完整且效率低下,并且需要使用人类胎儿卵巢细胞 - 其衍生刚刚从体外多能干细胞中建立。
此外,尽管做出了勇敢的努力,但作者仍无法从来自相同雄性iPSC的体外精子和卵子中产生可行的胚胎,这可能是上述许多前景的主要障碍。对此的一种解释可能在于印记 - 从胚胎父母那里遗传的DNA的性别特异性化学修饰。印记确保只有从母亲或父亲那里遗传的某些基因的副本在胚胎中表达,防止基因的过度表达。印记标记的不匹配可能导致某些基因错误地表达不足或过度表达,从而导致发育缺陷。
常规细胞培养中非整倍性的风险是一把双刃剑。它要求开发改进的培养条件,特别是基于细胞的疗法。但它也提供了对基本细胞过程的见解。作者观察到的染色体丢失的相对罕见性意味着多能干细胞具有活跃的DNA修复和基因组监视机制,以保护它们免受有害突变的侵害。这些尚不为人知的机制在体内更加强大——在小鼠和人类胚胎中,非整倍体细胞被转移到胚胎外支持谱系,如胎盘,以保护胚胎本身。体外和体内细胞之间行为的这种对比表明,在使用培养的干细胞在培养皿中制作人类卵子之前,还有很多东西需要学习。
原文链接:https://www.nature.com/articles/s41586-023-05834-x































