近日,美国得克萨斯大学达拉斯分校郑杰教授和余梦晓副教授团队,揭示一种正常细胞清除细胞器的新方式。

▲图 | 余梦晓(来源:余梦晓)
在用电镜观察小鼠肾脏时,他们发现正常状态下的肾脏近端小管上皮细胞,可以通过挤压管腔一侧的胞浆和细胞膜,在管腔中形成 5 微米左右囊泡(如下图所示)。
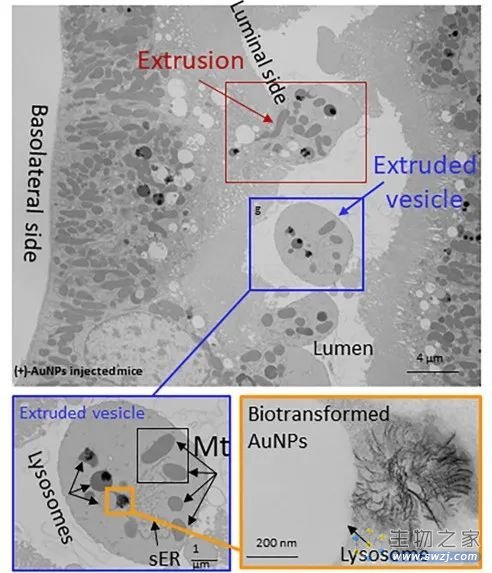
▲图 | 给小鼠尾部静脉注射 2-3 纳米金颗粒 24 小时之后,取小鼠肾脏制备的电镜样品和拍摄的透射电镜图像(来源:资料图)
借助这种方式可以清除线粒体、溶酶体、内涵体、内质网、甚至是细胞核。课题组把这一过程称为挤出细胞器(organelle extrusion)。
这说明,正常细胞可能会通过主动清除细胞器的方式,来实现自我更新从而保持健康。相比细胞受损、或处于应激状态时清除细胞器的情况,本次发现的现象并不相同。
而该团队之所以关心肾脏近端小管上皮细胞,是因为它是肾脏中数量最多的细胞,承担着重要的肾脏生理功能。因此,维持近端小管上皮细胞的健康,对于保持肾脏功能至关重要。
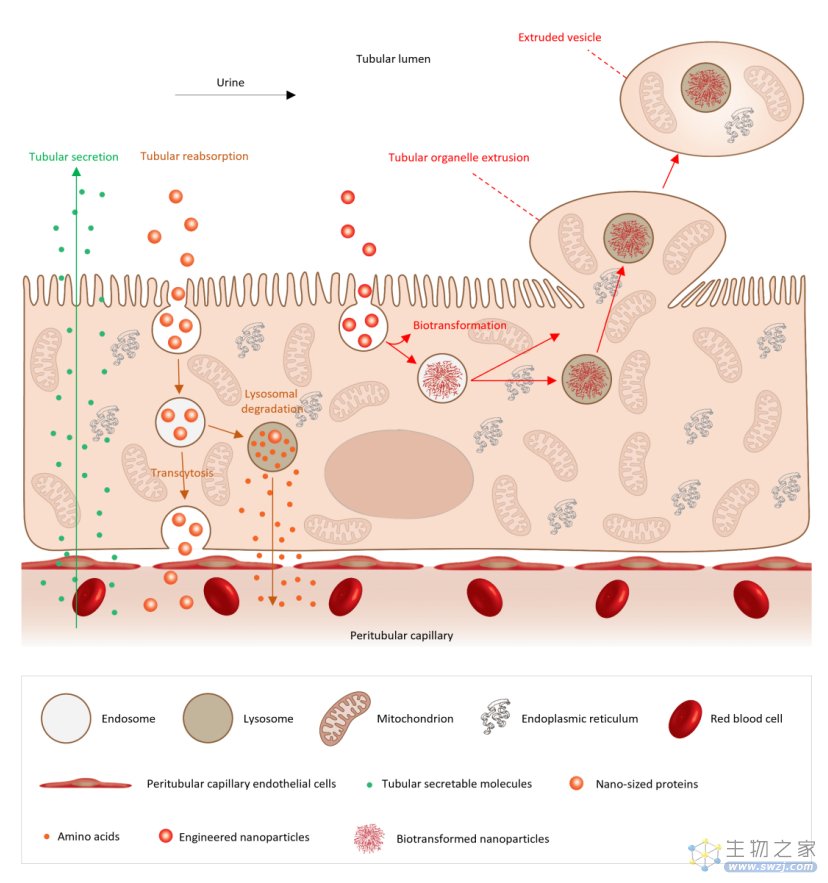
此外,他们还发现了一种细胞清除纳米材料的新方式。肾脏近端的小管上皮细胞,可以通过挤出细胞器的方式,把溶酶体中的纳米粒子排出细胞外,随后通过尿液排出体外。这一过程和已知的胞吐作用并不一样。
众所周知,纳米技术可以提高疾病诊断准确性和治疗有效性。同时,为了降低纳米材料注入体内之后的毒副作用,还需要加快体内清除纳米材料的速度。
通过将纳米材料的尺寸降到 6 纳米以下,并使用防止蛋白吸附的亲水配体来包裹纳米材料,目前已有多种纳米材料可以被肾小球滤过,从而快速排到尿液中。
但是,由于肾脏近端小管上皮细胞具有强大的吸附能力和内吞能力,当肾小球滤出的纳米材料流经肾小管管腔之时,仍然会有一部分纳米材料被近端小管细胞内吞,进而滞留在肾脏之中。
据介绍,过去十几年间郑杰和余梦晓实验室一直在研究肾清除金纳米粒子和肾脏的相互作用。
他们发现当给小鼠静脉注射金纳米粒子一天之后,肾脏中的金含量会随时间延长而降低。那么,肾脏到底是如何排出细胞内的纳米材料的?正是在回答该问题的过程中,他们发现了这种新的清除机制。
日前,相关论文以《近端小管通过细胞器挤压介导的自我更新机制消除内吞的金纳米颗粒》(Proximal tubules eliminate endocytosed gold nanoparticles through an organelle-extrusion-mediated self-renewal mechanism)为题发在 Nature Nanotechnology 上 [1],黄颖钰博士是第一作者,郑杰教授和余梦晓副教授担任共同通讯作者。

▲图 | 相关论文(来源:Nature Nanotechnology)
其中一位审稿人表示:“这篇论文报道了关于近端小管细胞的一个潜在重要发现。本次工作主要包括两个方面:一个是组织如何处理和清除用于药物递送或成像的纳米粒子;另一个则是既意外又幸运的发现,即研究人员部分地表征了似乎是一种新的、但是是由正常细胞清除和更新细胞器的过程,这个过程或许能被证明是一种必不可少的细胞‘清理’功能。但是,其他类型的细胞可能也有这种现象,而且可能并不仅仅限于极性上皮细胞。”
另一位审稿人表示:“本次研究呈现了一种重要且新颖的机制,阐述了纳米粒子借助挤出细胞器的方式,从肾脏中清除的原理。该研究证明超小纳米粒子可以进入肾脏近端小管上皮细胞,进而发生生物转化,并通过类似囊泡的结构被排出细胞。
这种单向传输机制似乎是肾脏的一种自然清除过程。尽管该领域内存在各种主张和观点,但是我们仍然不清楚纳米粒子一旦注入体内会发生什么。而类似于本次工作的基础型研究,对于纳米粒子在体内应用的工程设计至关重要,因此这项研究可以填补领域内的一个重要知识空白。”
(来源:Nature Nanotechnology)
据介绍,本次研究的起点来源于:该团队一直对体内肾小球滤出的纳米材料和肾脏近端小管细胞的相互作用非常感兴趣。那么,如何通过改变纳米材料表面电荷,来调控这些相互作用?
如果可以找到这些规律,则将指导他们设计出更安全、更有效的纳米药物。2020 年初,已经成为 PI 的余梦晓获得 NIH/NIDDK R01 项目的资助,于是开始深入开展这一课题。
期间,他们合成了几种 2-3 纳米金颗粒,分别带有不同的表面电荷。结合从活体小动物到组织、再到细胞和细胞器水平的成像方法以及定量分析方法,他们发现表面正电荷能够显著提高近端肾小管上皮细胞对于纳米粒子的摄取能力。
有意思的是,无论近端肾小管摄取纳米粒子的效率是高是低,95% 以上内吞到细胞的金纳米粒子,都能在一个月内从近端肾小管细胞中得到清除。
由于光学显微镜的分辨率不够,尽管他们可以看到肾小管上皮细胞里的纳米材料随时间延长而减少的规律,但是依旧不清楚具体的清除机理。
余梦晓说:“研究转折点是在 2021 年底学校放假前,郑杰老师和我们一起做电镜实验的时候,他注意到肾脏近端小管细胞挤出的囊泡里,同时存在纳米粒子和线粒体,这个现象很不寻常。”
随后,当肾脏近端小管上皮细胞不吞噬金纳米粒子时、以及内吞不同数量金纳米粒子时,他们比较了其中的三种情况。
借助电镜实验和分析测量,课题组发现通过挤出细胞器形成的囊泡,在数量和尺寸上并没有统计学上的差异。
这说明细胞产生这些微米囊泡,并不是由于细胞内吞金纳米粒子引起的,很可能是一种肾脏近端小管的正常生理现象。针对这一过程,研究人员将其命名为“肾小管细胞挤出细胞器”。
论文一作黄颖钰介绍称,随着研究的深入,工作重点也从理解近端肾小管和纳米粒子作用的电荷选择性,转变为探索细胞内纳米粒子的生物转化,最终进展到发现近端肾小管的 organelle extrusion 现象。
期间,他们多次推倒已经写完的稿子,配上重新组织的图表重新写一遍,在投稿之前估计写了一百多稿。
其继续表示:“这篇论文包含着我在六年之间的努力,跨越博士、博士后和研究科学家三个阶段。让我印象深刻的不是我们所花费的时间,而是它为我所树立的研究标准,即从事生医研究不仅要对新领域保持开放态度,还要对基础生理学知识有着持久追求。”
余梦晓则表示:“非常感谢我的博士后导师、也是我现在的同事郑杰教授,他为年轻学者创造了独立自由成长的环境。郑老师鼓励我们选择困难但会带来成长的道路,放下自我证明的需要,感受科学的丰富、生动和美,保持诚实和真实,保持开放的态度接收新的信息和观点,向别人学习,也从自己的错误中学习。在职位和收入方面,郑老师为我们提供了最大的支持,让我们不仅能做好研究,也能拥有好生活。
得州大学西南医学中心泌尿科的谢哲宗教授(Dr. Jer-Tsong Hsieh)则是我进入肾脏研究的第一位老师,也是我学习的榜样。他一直在实验室的一线工作,跟他做实验总是非常愉快,而且很容易被他投入做研究的热情、无私分享实验细节的精神感动。
我很高兴可以做关心人的研究,找到了做研究和个人成长一致的道路。在日常中练习,在每一次实验和写作中练习。把论文当做作品,努力写到自己满意的程度。我想论文真正的完成是在读者心中产生回响,论文的写作是为知己写作。”
不过,正如英国伦敦大学学院罗伯特·安文教授(Robert Unwin)针对本次论文所写的评论文章所言:“目前看来,它提出的问题多过提供的答案。这是一种由于接触人工合成的不可降解的纳米粒子所引发的独特过程,还是一种正常的细胞‘清理’功能?
以这种方式排出的细胞器是否存在微小的损伤或异常,或者这是它们正常更新的一部分?是什么触发了这个过程,它是如何被调控的?它是否在疾病中起到作用,或者可以被善加运用为治疗服务?它是所有细胞类型的特性吗?“
其实,不仅是外部专家观察到了以上问题,课题组自己也将继续探索上述问题,力图回答更多的“为什么”。
据了解,肾脏近端小管上皮细胞的病变,是很多肾脏疾病的起源。因此,课题组期待在深入研究肾小管细胞挤出细胞器这一生理现象之后,为肾病诊断和治疗提供新方法。
正如美国作家罗伯特·波西格(Robert Pirsig)在《禅与摩托车维修技术》一书里所写的,科技的本质是“把自然与人的精神融合为一,创造出可以超越二者的产物。当这种产物出现,就像第一架横越海洋的飞机,或是人类第一次踏上月球,全人类就会对科技的超越性有全新的认识”。
参考资料:
1.Huang, Y., Yu, M. & Zheng, J. Proximal tubules eliminate endocytosed gold nanoparticles through an organelle-extrusion-mediated self-renewal mechanism.Nat. Nanotechnol. (2023). https://doi.org/10.1038/s41565-023-01366-7
2.Unwin, R. Transport mechanisms. Nat. Nanotechnol. (2023). https://doi.org/10.1038/s41565-023-01364-9
3.Du, B., Yu, M. & Zheng, J. Transport and interactions of nanoparticles in the kidneys. Nat Rev Mater 3, 358–374 (2018). https://doi.org/10.1038/s41578-018-0038-3
4.Yu, M., Xu, J. & Zheng J. Renal Clearable Luminescent Gold Nanoparticles: From the Bench to the Clinic. (2018) https://doi.org/10.1002/anie.201807847
5.Yu, M. & Zheng, J. Clearance Pathways and Tumor Targeting of Imaging Nanoparticles. ACS Nano.(2015) https://doi.org/10.1021/acsnano.5b01320































