编辑推荐:
通过一系列欺骗免疫细胞的工具,研究人员正在扩大CAR-T疗法的范围。
Crystal Mackall还记得,当她第一次听到有关利用T细胞识别和杀死癌症的方法的讲座时,她所持的怀疑态度。1996年,在德国的一次会议上,这位儿科肿瘤学家坐在观众席上,转向她旁边的人说:“不可能。这太疯狂了。”
今天,情况不同了。Mackall说,“我已经被驯服了,”她现在在斯坦福大学工作,开发这种细胞来治疗脑瘤。2017年,美国食品和药物管理局批准了第一批被称为嵌合抗原受体(CAR)-T细胞的修饰T细胞,用于治疗一种白血病。这些治疗方法已经改变了几种癌症的游戏规则。五种类似的产品已获批准,超过2万人接受了这种治疗。一个曾经只有少数顽强的研究人员在推动的领域,现在在学术界和工业界拥有数百个实验室团队。超过500项临床试验正在进行中,随着研究人员竞相改进T细胞设计并扩展其功能,其他方法也正准备从实验室跳到临床。“在未来的几年里,这个领域将把癌症远远抛下,”Mackall预测。
通过CRISPR等技术进行基因组编辑的技术进步,以及通过合成生物学重新连接细胞的能力,已经导致了修改和增强T细胞治疗的方法越来越精细。这些技术正在提供工具,以应对当前CAR-T疗法的一些局限性,比如目前这些疗法制造成本高,可能有危险的副作用,而且迄今为止只对血癌成功。
宾夕法尼亚大学的癌症免疫学研究员Avery Posey说:“这些技术已经扩大了我们使用CAR策略的能力。它将真正把这种类型的技术向前推进。”
即便如此,从人体细胞中制造这样一种“活体药物”的挑战不仅仅是复杂的设计。许多最新的候选药物的安全和制造问题仍有待解决。纽约市纪念斯隆·凯特琳癌症中心的免疫学家Michel Sadelain说:“现在这些非常奇妙的东西正在激增,我认为这很棒。但其复杂性并不总是像描述的那样,顺利进入临床环境中。”
全速前进,准备出发
CAR-T疗法利用了T细胞的活动,T细胞是免疫系统的天然猎人,在体内徘徊,寻找不属于自己的东西。外来细胞,或者那些被病毒感染的细胞会表达不寻常的蛋白质,这能充当T细胞的信标,其中一些T细胞会释放有毒的分子来摧毁不正常的细胞。这种搜索和破坏功能也可以针对癌细胞进行消灭,但肿瘤总有办法解除免疫系统武装,例如通过隐藏异常蛋白质或抑制T细胞功能。
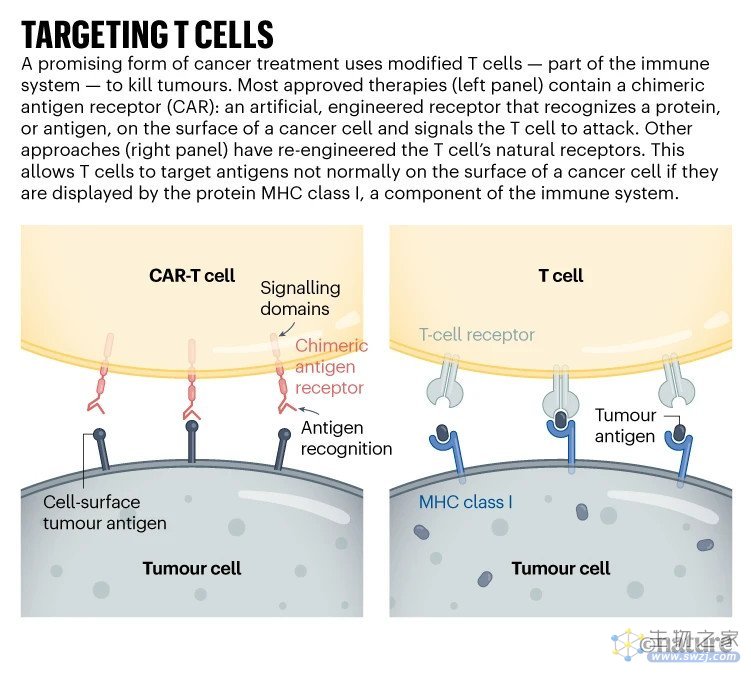
CAR-T细胞携带合成蛋白质——嵌合抗原受体,跨越细胞膜。外层是一种功能类似抗体的结构,与某些癌细胞表面的特定分子结合。一旦与t细胞结合,细胞内的蛋白质部分就会刺激t细胞的活动,将其激活。结果就是变成一台微小的、加速的抗癌机器。
经批准的CAR-T疗法针对免疫细胞B细胞上发现的两种蛋白质中的一种,用于治疗某些形式的白血病和淋巴瘤,其中涉及这些细胞的无节制增殖。CD19和BCMA蛋白质并不是癌症所特有的,这意味着这些疗法可以不加区别地杀死B细胞。然而,没有这些细胞,人类也能生存。
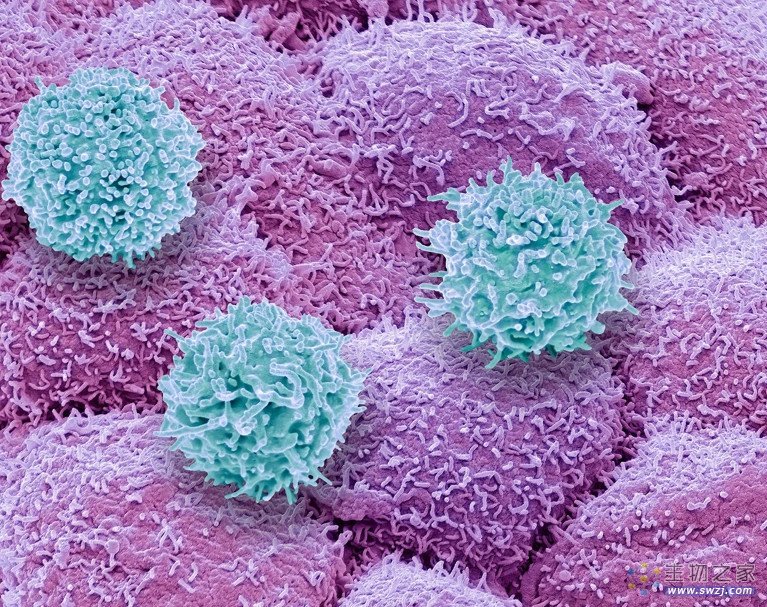
免疫系统的T细胞(蓝色)正在攻击前列腺癌细胞(粉红色)。
CAR-T疗法仍有很大的改进空间。尽管这些影响可能是长期的——有时甚至是可治愈的,但大多数接受治疗的人最终会复发。实体肿瘤,如肺癌或胰腺癌,到目前为止对CAR-T细胞没有令人信服的反应。这种疗法存在安全风险,在极少数情况下可能致命。而且它必须为每个接受者定制,使用他们自己的T细胞作为起点,这导致了相对缓慢和昂贵的制造过程。
到目前为止,这些问题都没有简单的解决办法。“我们显然还有很长的路要走,”Mackall说。“但我们现在看到了希望。”
治疗实体瘤已经取得了一些进展。这些肿瘤通常包含有不同突变组合的异质性细胞。这意味着针对特定突变蛋白的CAR-T疗法可能只对一个细胞子集有效。实体瘤的致密肿块也很难让T细胞穿透,研究人员一直在努力寻找不会对健康组织造成破坏的合适靶点。
不过还是有一些临床试验显示出了一些疗效。Mackall和她的同事们设计了CAR-T细胞来靶向一种叫做GD2的蛋白质,这种蛋白质在一些被称为胶质瘤的脑癌和脊髓癌中表达量很高。研究小组给患有神经胶质瘤的患者静脉注射了一剂CAR-T疗法,然后将多个较低的剂量直接注入大脑。她和她的同事去年报告说,接受这种治疗的四分之三的人有积极的反应。“这些细胞直接潜入大脑,身体不会排斥它们——它在免疫特权空间里发挥作用。”
瞄准实体瘤可能需要识别一种以上突变蛋白的T细胞疗法,或者可以靶向表达高于正常细胞的特定蛋白质水平的癌细胞。2022年11月报告的一项临床试验将这种情况发挥到了极致:该团队没有使用CARs,而是使用CRISPR来改造天然T细胞受体,以识别每个参与者肿瘤中发现的突变蛋白。这些个体接受了针对不同蛋白质的混合细胞,希望实体肿瘤不太可能对具有多个靶点的治疗产生耐药性。在治疗28天后,16名参与者中有5人的肿瘤停止生长。研究人员希望调整方案,包括提高剂量,以提高有效性。
资料来源:Premier Research
宾夕法尼亚大学的免疫学家Carl June说,追踪和微调T细胞活动的能力也在提高。通过先进的单细胞分析,研究人员可以跟踪工程细胞和它们被设计杀死的肿瘤的命运。他们可以确定哪些T细胞已经“耗尽”——一种可能来自长时间刺激的功能失调状态,以及哪些肿瘤细胞对治疗产生了耐药性。他们还可以看到CAR-T治疗肿瘤周围的环境是否充满了免疫抑制细胞(如巨噬细胞或调节性T细胞)。总部位于新加坡的生物技术公司UTC Therapeutics正在开发CAR-T疗法,该公司首席科学官Yangbing Zhao表示,克服这种局部免疫抑制将是利用T细胞对抗实体肿瘤的关键。他说:“不管你瞄准了多少个目标,如果肿瘤逃避了免疫反应,它就不会起作用。”
June和他的同事使用单细胞方法来研究靶向CD19的CAR-T疗法的耐药性,发现CAR-T产品不能激活某些辅助T细胞与耐药性的出现有关。他们还使用单细胞技术来更多地了解为什么CAR-T细胞针对胰腺癌细胞中被称为间皮素的蛋白质经常失败。降低CAR-T细胞中两种基因的活性可能会增强这种疗法。June说:“我们将能够了解这些抗性机制。然后利用CRISPR等所有这些工具,我们将围绕它们进行工程设计。”
除了编辑T细胞,CRISPR还被用于寻找更多修改T细胞的方法。加州旧金山格莱斯顿研究所的免疫学家Alexander Marson和他的同事们使用CRISPR激活或抑制T细胞中的数千个基因,然后观察这些变化对称为细胞因子的关键免疫调节蛋白的产生的影响。在另一个使用CRISPR的筛选中,研究小组发现,降低一种名为RASA2的蛋白质的活性可以增强CAR-T细胞杀死目标的能力。Marson说:“我们正在学习有关基因的知识,我们可以上调或下调这些基因,以调整T细胞,使其按照我们想要的方式发挥作用。”
合成生物学家也将目光投向了T细胞,他们正在设计复杂的细胞回路,以便更好地控制CARs和其他可能增加T细胞活性的蛋白质的表达。去年12月,加州大学旧金山分校的合成生物学家Wendell Lim和他的同事报告说,他们改造了T细胞,使其能够表达CAR和IL-2(一种免疫调节蛋白)。IL-2可以促进t细胞对实体肿瘤的渗透,并克服肿瘤释放的免疫抑制信号,但当全身给药时可能是有毒的。让T细胞产生IL-2可以在局部给药,从而绕过它对其他组织的毒性。
其他的合成电路已经被设计用来精确调控CAR的表达,方法是将其置于基因元件的控制之下,这些基因元件对药物反应时激活必要的基因。Sadelain说,然而,到目前为止,这些复杂的设计中的大多数还没有通过用于人体所需的安全性研究和标准化。
波士顿麻省总医院的肿瘤学家Marcela Maus说,研究人员正在吸取更多的经验教训,现在该领域的一个大问题是确定哪些工程T细胞可以用于人体研究。"我们可以在实验室里进行大量的发明和创新,但还要有一个将其转化为临床试验的漏斗。我们有这么多事情可以做,必须弄清楚哪些是可以在试验中进行调整和测试的最佳事情。"
昂贵的治疗
按照制药标准,CAR-T细胞的制造已经非常复杂。到目前为止,所有被批准的疗法都需要改造一个人自己的T细胞来表达CAR。这增加了生产治疗方法的时间和成本:在美国,使用CAR-T细胞进行一次治疗大约需要50万美元,这还不包括住院和相关治疗的费用。
制造可用于多人的CAR-T细胞(通常被称为现成细胞)一直被视为降低治疗价格的关键。但是印度理工学院孟买分校的生物工程师Rahul Purwar说,早期的结果表明,还有很多工作要做。尽管这些细胞可以被编辑以减少它们自己被免疫系统消灭的机会,但早期的试验表明,它们在输注后不能存活很长时间,仍然可能被排斥。他说:“目前的方法很好,它正在到来,但现在我们还没有到那一步。”
这种疗法在富裕国家之外也很少使用。在巴西,血液学家Renato Luiz Guerino Cunha是该国第一个在2019年用CAR-T疗法治疗患者的科学家。但他说,进展缓慢,他缺乏快速生产大量细胞的能力。“三年来,我们只治疗了6名患者。我们需要新的加工技术。”
制造一种CAR-T细胞疗法通常需要使用一种称为慢病毒的病毒作为载体,在合成的CAR基因中穿梭。但对基因疗法的更多研究增加了对临床级慢病毒的需求。研究人员现在要等上几个月,并支付高额费用才能完成实验,Cunha自己生产,但产量很小。CRISPR基因编辑技术的改进可能会在这方面有所帮助。
尽管面临挑战,CAR-T疗法仍在继续扩展,全球数百项临床试验中的一些已经探索了全新的应用。去年,研究人员报告了一项CAR-T疗法治疗一种自身免疫性疾病狼疮的小型试验,取得了令人鼓舞的结果。在一项针对小鼠的研究中,研究人员对T细胞进行了重新编程,而没有采取通常的第一步,即从体内移除T细胞,产生了用于清除心脏瘢痕组织的CAR-T细胞。
去年12月,June和他的同事们公布了一种简化细胞生产的方法。在美国血液学学会年会上,研究小组宣布,减少制造时间,改造CAR-T细胞,使其表达一种名为IL-18的蛋白质,提高了它们的功效,并使研究人员能够减少给人使用的细胞剂量。“这些病人有令人难以置信的反应,”Maus谈到临床试验时说,“这给了你一个非常诱人的暗示,如果你能更好地改造T细胞,你就能让它更强大。”































