
经过多年研发,随着mRNA递送系统的突破,mRNA新冠疫苗成功上市并得到广泛应用,并成为了新冠疫苗的领跑者。与灭活疫苗、重组蛋白疫苗等传统疫苗相比,mRNA疫苗可以简单、快速更新,以应对病毒变异,为新疫苗的开发节约了大量时间和成本。
目前的mRNA疫苗或疗法很大程度上依赖于脂质或类脂质递送系统(例如LNP),来提高mRNA在体内的转染效果。尽管mRNA技术优势明显,但在理化稳定性方面面临的挑战仍阻碍了它们的可及性,例如,目前获批的两款mRNA,Moderna公司开发的mRNA-1273需要在-20°C的低温下保存和运输,而辉瑞/BioNTech公司开发的BNT162b2则更是需要−80°C至−60°C的低温。因此,开发一款更稳定的、可在常规冷链运输的mRNA-LNP疫苗很有必要。
2023年1月23日,瑞吉生物胡勇博士、武汉大学蓝柯教授等在 Cell Discovery 期刊发表了题为:Lyophilized mRNA-lipid nanoparticle vaccines with long-term stability and high antigenicity against SARS-CoV-2 的研究论文【1】。
研究团队针对mRNA-LNP优化了冻干技术,开发了针对Omicron突变株的mRNA疫苗——LyomRNA-Omicron,这款冻干mRNA-LNP疫苗具有更强的耐热性和可及性,能够解决目前mRNA-LNP疫苗的储存和运输难题。
这款冻干mRNA-LNP疫苗在小鼠、兔子和老年恒河猴体内可诱导产生有效的体液免疫和细胞免疫。在人体试验中,相比接种两剂灭活疫苗,该疫苗作为加强针接种后,可诱导产生针对Omicron BA.1、BA.2和BA.4的高水平中和抗体,中和抗体滴度至少增加了253倍,且没有发生明显不良反应。
总的来说,冻干mRNA-LNP疫苗具有高安全性、高免疫原性和可及性的优点,非常适用于新冠等流行病的预防。

2021年12月,Signal Transduction and Targeted Therapy 期刊发表一篇论文【2】,报道了一种LNP递送的mRNA疫苗,可在2-8℃条件下稳定6个月时间,但该论文并未提供LNP配方以及该疫苗运输稳定性的细节。
在溶液状态下,LNP的几种组分会相互作用,影响长期稳定性,而在运输过程中的振动,会更加影响稳定性。
冻干(Lyophilization),是在真空状态下通过低温升华除去水分的过程,这是一种相对温和的干燥方法,适用于对脆弱的生物大分子或胶体纳米颗粒的干燥。在除去水分和氧气后,冻干mRNA可在室温下保存较长时间。但是,对mRNA-LNP的干燥却要复杂得多,因为冷冻和脱水过程中会引入机械力,这会使得LNP结构变化,导致纳米颗粒聚集、mRNA链断裂或从LNP中泄漏。
此外,还有研究显示,在冻干后,即使mRNA-LNP保留了其完整性和封装效率,它们在体内的转染效率仍会大大降低。而宾夕法尼亚大学Norbert Pardi等人开发了一种冻干mRNA-LNP,可在4°C和25°C下具有良好的热稳定性,持续24周,而在40°C时,mRNA完整性急剧下降【3】。
在这项研究中,瑞吉生物的研究团队开发了一种精准温控、残留含水量更低的优化的冻干技术,使用这一技术的冻干mRNA-LNP,在2-8℃、室温,甚至40℃的高温下长期保存仍能有效保持理化性质和生物活性。这种升级的热稳定性在包含不同mRNA的mRNA-LNP中得到了验证,表明了该冻干技术的广泛适用性。
胡勇于2012年在武汉大学生科院获得博士学位后前往哈佛大学开展博士后研究工作,在美国国家工程院院士、著名转化医学专家 Martin Yarmush 实验室,胡勇开始了mRNA治疗药物的开发以及相关底层技术的研究。
2018年,胡勇回国并加入了中科院深圳先进技术研究院。2019年9月,胡勇创立了瑞吉生物,致力于开发基于mRNA的疫苗及治疗药物。此时,新冠疫情尚未暴发,mRNA在全球范围内都属于新兴赛道,瑞吉生物也称为国内最早的mRNA技术公司之一。
2022年6月以来,瑞吉生物主导研发的全球首款冻干型新冠mRNA疫苗(Omicron)RH109分别在菲律宾、新西兰和中国香港获得临床批件,并在国内开展了研究者发起的临床试验。

研究团队利用上述技术,制备了编码新冠病毒原始毒株、Delta及Omicron突变株的刺突蛋白的NTD-RBD区域的冻干型耐高温mRNA-LNP疫苗。接下来研究团队在小鼠、兔子上验证这些疫苗的安全性和有效性。
由于老年人最易受到新冠感染的影响,研究团队还在老年恒河猴(6岁)上进行了验证,结果显示,间隔21天的两次冻干Omicron mRNA-LNP疫苗(LyomRNA-Omicron)接种,能够同时诱导针对Omicron BA.1、BA.2以及野生型病毒的中和抗体。
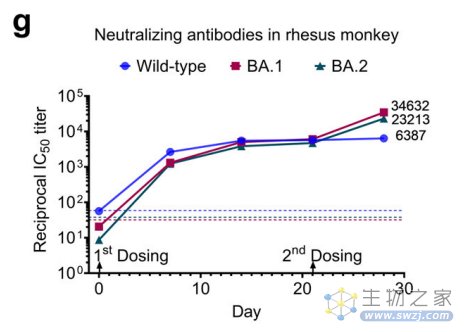
老年恒河猴接种两剂LyomRNA-Omicron疫苗,能够产生高水平中和抗体
由于Omicron的高逃逸能力,疫苗加强接种很有必要,在我国,灭活疫苗是最广泛接种的新冠疫苗。研究团队设计了在接种灭活疫苗的基础上进行LyomRNA-Omicron疫苗加强接种的实验。
在小鼠中,在接种两剂灭活疫苗后,使用灭活疫苗或LyomRNA-Omicron疫苗进行第三针加强接种,结果显示,LyomRNA-Omicron疫苗加强接种能够大幅提高中和抗体滴度。
而在老年恒河猴中,两剂灭活疫苗接种18个月后,再使用LyomRNA-Omicron疫苗进行第三针加强接种,能够诱导产生针对新冠病毒野生型、Omicron BA.1和BA.2的高水平中和抗体。这表明,在灭活疫苗接种很长一段时间后,灵长类动物体内针对新冠病毒的中和抗体水平已经很低的情况下,LyomRNA-Omicron疫苗加强接种仍然可以诱导高水平中和抗体。
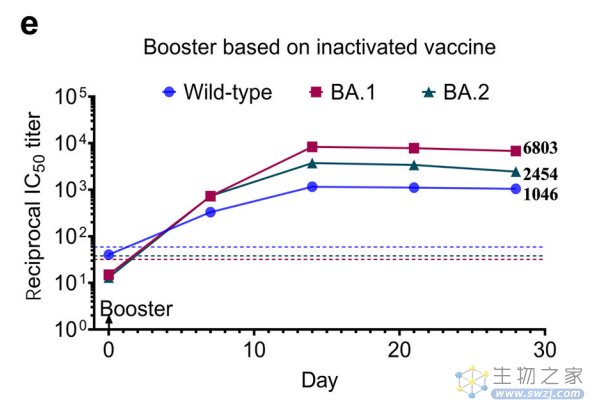
老年恒河猴加强接种LyomRNA-Omicron疫苗,可诱导高水平中和抗体
鉴于上述优异的实验结果,研究团队进行了研究者发起的临床试验(IIT),共26名志愿者参与,其中19人此前接种2剂灭活疫苗,最后一剂接种在6个月前,其余7人接种了3剂灭活疫苗,最后一剂接种在2个月前,前者被分配到队列1,后者被分配到队列2。
在队列1中,志愿者体内针对新冠病毒尤其是针对Omicron的中和抗体滴度几乎为0,而在加强接种LyomRNA-Omicron疫苗14天后,他们针对新冠病毒原始毒株、Omicron BA.1、BA.2的中和抗体滴度分别提高到了加强接种前的253倍、725倍和420倍。此外,相比使用灭活疫苗进行第三剂加强接种,使用LyomRNA-Omicron疫苗加强接种能够将中和抗体滴度提高数十倍。
在队列2中,使用LyomRNA-Omicron疫苗进行第四剂加强接种14天后,他们针对新冠病毒原始毒株、Omicron BA.1、BA.2的中和抗体滴度分别提高到了加强接种前的131倍、251倍和98倍。
此外,在加强接种LyomRNA-Omicron疫苗后,针对Omicron BA.4仍能保持很高的中和抗体水平。
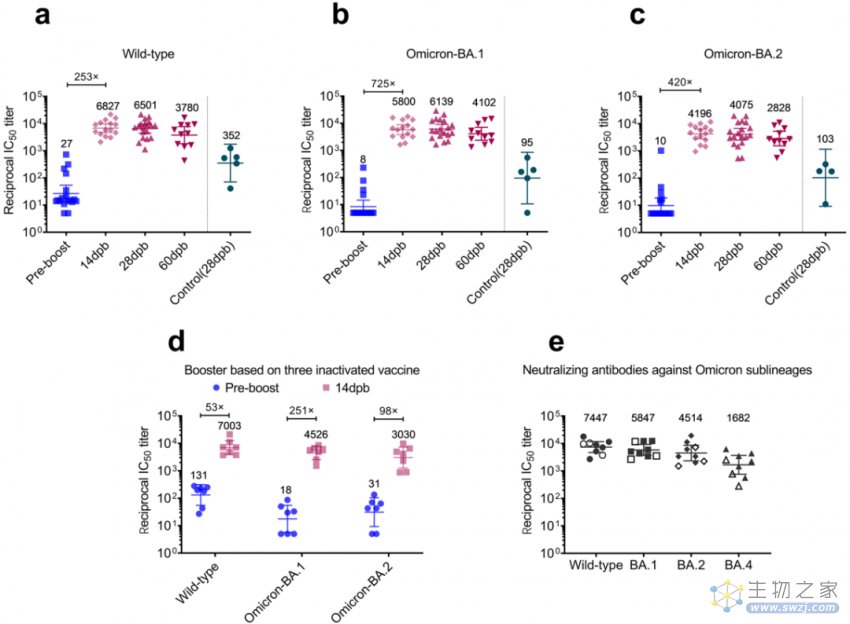
使用LyomRNA-Omicron疫苗进行加强接种,可在人体内诱导产生高滴度中和抗体
在这26名接种LyomRNA-Omicron疫苗的志愿者中,没有观察到2级及以上不良事件,没有人的体温超过37.5°C,有4人出现轻度症状(1人肌肉注射部位红肿,1人头晕,2人腋窝淋巴结疼痛)这些症状均在5天内消失。
这些结果表明,LyomRNA-Omicron适合作为灭活疫苗的加强疫苗,对新冠病毒野生型和Omicron突变株具有良好的免疫效果,同时副作用轻微。
论文链接:
https://www.nature.com/articles/s41421-022-00517-9
https://www.nature.com/articles/s41392-021-00861-4
https://doi.org/10.1016/j.ymthe.2022.02.001































