一直以来,耐药性都是肿瘤研究的热点和难点。
耐药性是如何产生的呢?作用于RNA1(ADAR1)的腺苷脱氨酶,通过在应激反应期间防止逆转录病毒整合以及逆转录转座,来保持基因组完整性。然而,炎症微环境诱导的ADAR1p110到p150剪接亚型转换,驱动了20种恶性肿瘤中癌症干细胞(CSC)的生成,导致耐药性的产生。
近日,来自美国加州大学的研究者在《Cell Stem Cell》发表了题为“Reversal of malignant ADAR1 splice isoform switching with Rebecsinib”的研究论文,结果表明,Rebecsinib可以抑制ADAR1p150驱动的白血病干细胞自我更新,同时保留正常造血干细胞。同时,Rebecsinib的pre-IND(Investigational New Drug)研究,显示了良好的毒代动力学和药效学特征。

一、研究背景
首先,来给大家介绍一下,Rebecsinib是啥?
Rebecsinib是一种通过剪接介导的、可活化ADAR1的选择性小分子抑制剂,它可以抑制白血病干细胞(LSC)的自我更新。在保留正常造血干细胞和祖细胞(HSPC)的剂量下,Rebecsinib可以延长人源化白血病干细胞小鼠模型的存活期。
然而,预测和预防ADAR1p150介导的恶性RNA编辑是一项重大挑战。鉴于此,研究人员开发了慢病毒ADAR1和剪接报告子,用于无创检测剪接介导的ADAR1腺苷到肌苷(A-to-I)的RNA编辑激活。
二、研究方法
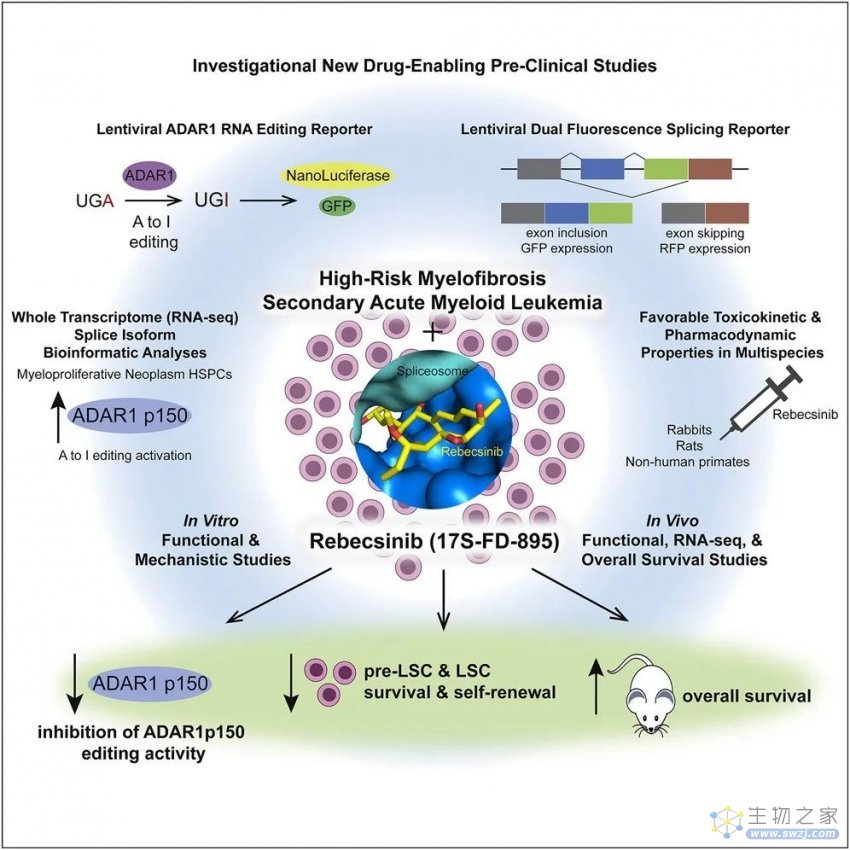
图注:研究摘要图。(来源:Crews L., et al. 2023)
1、样本、全转录组RNA测序、RNA编辑和剪接异构体分析
首先,采集骨髓增生性肿瘤/急性髓系白血病患者的原始外周血或骨髓样本,以及非骨髓增生性肿瘤患者的骨髓对照样本。接着,经FACS纯化、依据标准流程处理样本后,进行全转录组RNA测序。具体来说,使用FastQC、STAR v2.5.1a aligner、RSEM48 v1.3.0和GENCODE annotation等工具对数据进行处理。
在Rebecsinib剂量反应试验中,5或10mg/kg每周给药一次sAML50261移植小鼠,从脾脏中分离CD34+细胞;10mg/kg每周给药两次sAML50261移植小鼠,收集CD34+细胞。用于全转录组测序数据的RNA编辑分析。
2、慢病毒RNA剪接和ADAR1编辑报告
为了实现实时、活细胞RNA剪接和编辑定量检测,研究人员设计并测试了慢病毒双荧光RNA剪接和ADAR1依赖性RNA编辑载体在人类白血病细胞系中的活性。为了评估ADAR1依赖性编辑,构建了慢病毒报告子,通过荧光和/或发光来测量活性。
如下图所示:
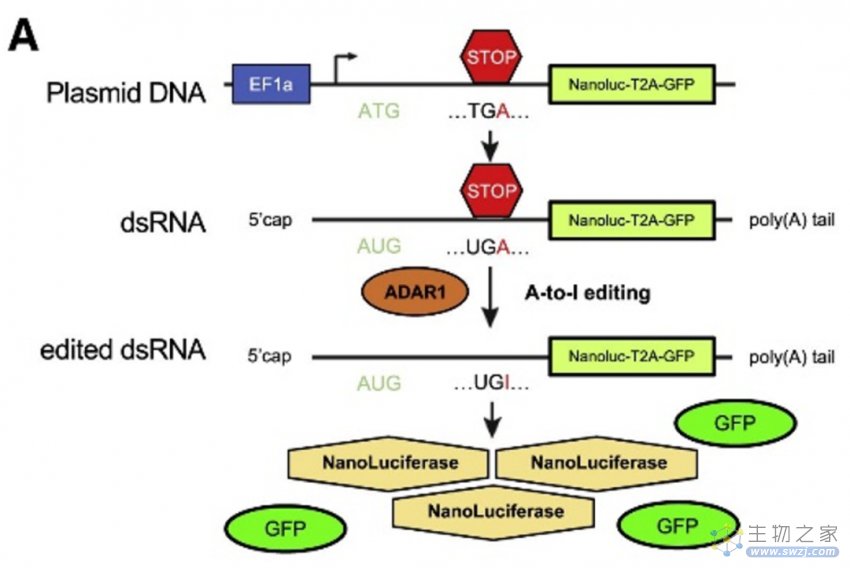
图注:合成包含ADAR1敏感终止密码子的RNA序列,该密码子在A-to-I编辑后读取,产生可由T2A切割位点分离的纳米荧光素酶和GFP蛋白。(来源:Crews L., et al. 2023)
3、体外细胞系治疗和分析
对ADAR1激活中慢病毒介导的人ADAR1进行敲除,以及纳米luc-GFP报告子和内源性转录物的RNA编辑生物标记物研究,研究人员使用靶向ADAR1(shADAR1)或干扰对照(shCtrl)的慢病毒shRNA载体,稳定地转导人白血病细胞,消除内源性ADAR1表达。
此外,研究者还使用人野生型或无催化活性(E912A)突变载体来选择性表达ADAR1p150。通过定量实时PCR评估病毒滴度,并在293T细胞中测试转导效率。对于细胞系中的ADAR1蛋白异构体和STAT3磷酸化分析,进行了蛋白免疫印迹分析。
4、基质共培养物和ADAR1报告子测定
至于纳米荧光素酶RNA编辑活性测定,研究者使用ADAR1纳米luc-GFP报告子慢病毒,转导初级高危体外骨髓纤维化样品中的CD34+选择细胞48小时,然后在基质共培养物中用DMSO或Rebecsinib处理72小时。通过纳米Glo荧光素酶,测定发光报告子活性,将值标准化为细胞活力。
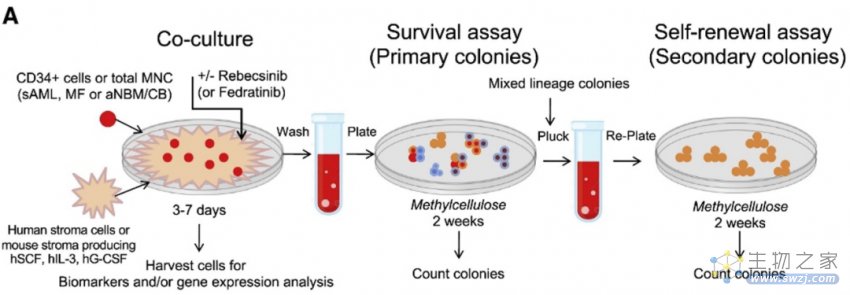
图注:体外骨髓纤维化(MF)造血祖细胞(HPC)和白血病干细胞存活和自我更新试验示意图。(来源:Crews L., et al. 2023)
5、剪接异构体特异性定量实时PCR
为了通过定量实时PCR定量分析剪接异构体表达、RNA编辑率和全基因表达,使用RNA裂解缓冲液处理细胞或组织片段,按照制造商方案提取总RNA。通过定量实时PCR定量ADAR1变体和白血病干细胞特异性转录物的水平。并对AZIN1转录物中的变体进行RNA编辑位点特异性定量实时PCR(RESSqPCR)。
6、细胞内ADAR1p150和磷酸-STAT3流式细胞术分析
进行干细胞和祖细胞表面抗体染色的流式细胞术。对于磷流,固定并渗透一部分样品,然后用APC结合的ADAR1p150抗体和pSTAT3 APC阻断和染色。使用BD LSR Fortessa和FlowJo软件分析馏分。
7、人源化白血病干细胞小鼠模型测定和人正常造血干细胞和祖细胞治疗指数研究
在人源化小鼠模型中,使用了两位患者的剪接因子突变或未突变的sAML细胞(CD34+),包括sAML50261和sAML2008-5。在体内疗效和治疗指数研究中,sAML CD34+细胞或正常人脐带血来源或老年骨髓来源的正常造血干细胞和祖细胞(CD34+)移植到新生Rag2-/-γc-/-小鼠中,或静脉注射到成年NSG-SGM3小鼠中。
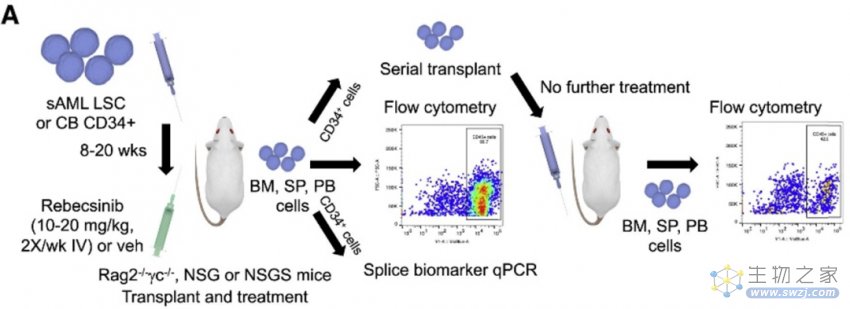
图注:显示原发患者白血病干细胞或脐带血移植小鼠的体内治疗和sAML系列移植研究的示意图。(来源:Crews L., et al. 2023)
使用治疗动物和对照动物的骨髓和/或脾脏的CD34+细胞,进行Rebecsinib治疗后的系列移植测定,包括植入研究和总生存率测定。在另一组动物中,采用Fedratinib治疗小鼠两周(每天两次,口服60 mg/kg),作为ADAR1表达和活性调节的阳性对照。
8、临床前毒代动力学(TK)、药代动力学和药效学(PD)研究
对Sprague-Dawley大鼠、新西兰白兔和食蟹猴(BASi/Inotiv)进行单剂量TK研究。对于非人灵长类动物(NHP)研究,在给药雷贝西尼之前和之后,进行健康和眼科评估,并收集血液样本,量化治疗动物和对照动物的血浆雷贝西单抗水平,和PBMC中的生物标志物研究。根据CRO批准的方案计算毒代动力学值,包括平均血浆浓度和t1/2值。
三、研究结果
研究人员通过ADAR1剪接异构体转换的转录组学检测,观察到标准ADAR1p150剪接亚型ADAR-202,和替代ADAR1p1150亚型ADAR-208的表达增加。研究人员构建了用于非侵入性检测A-to-I RNA编辑的实时慢病毒ADAR1报告子,且验证了特异性和灵敏度,能够检测到ADAR1p150的激活。
研究人员发现,抑制ADAR1p150的激活,可防止高风险的MF HPC和白血病干细胞,而Rebecsinib可以抑制ADAR1p150驱动的白血病干细胞自我更新,同时保留正常造血干细胞。Rebecsinib的PK、TK和PD临床前研究,显示出化学可扩展性和良好的药代动力学特征。
四、总结
综上所述,这些结果为开发Rebecsinib作为临床ADAR1p150拮抗剂奠定了基础,该抑制剂旨在消除高危MF和sAML患者中,白血病干细胞驱动的治疗耐药性和复发,并可能用于其他因ADAR1介导的免疫沉默,抵抗免疫检查点阻断的恶性肿瘤。
参考来源:
Crews LA, Ma W, Ladel L, et al. Reversal of malignant ADAR1 splice isoform switching with Rebecsinib. Cell Stem Cell. 2023;30(3):250-263.e6. doi:10.1016/j.stem.2023.01.008.































