生物传感器(Biosensor)是一种对生物物质敏感并将其浓度转换为电信号进行检测的物质。研究人员使用体内生物传感可以实时研究活生物体,组织或细胞,具有快速获得数据的优势。现在使用的生物传感器最初开发是用于神经细胞研究,之后研究人员对该传感器进行了改进和开发,使其可以在植物中使用,克服了以往方法既不能在活细胞进行检测及实时检测,亦不能检测植物内不同细胞以及不同亚细胞空间各自的分子水平。故生物传感器的利用,将极大促进研究人员对领域的深度认知。
我们注意到最近一年来,已经有5篇高水平文章(包括2篇Nature Plants 和 Nature Communication、PNAS及Plant Cell各一篇)利用传感器实时检测植物各代谢产物(NADH / NAD+、脂质磷脂酸PA、H2O2和ATP)的研究进展,对于各领域深入研究提供了有力的方法,开创了植物研究的新领域---利用传感器实时观察植物新陈代谢研究。它们分别是:
01
2020年6月26日,Nature Communications 杂志在线发表了来自香港大学林文量课题组题为“In planta study of photosynthesis and photorespiration using NADPH and NADH/NAD+ fluorescent protein sensors”的研究文章。该研究通过将两种新颖的传感器导入拟南芥,用于实时测量植物中NADPH水平和NADH / NAD+比率的动态变化.

线粒体在光合作用时究竟使用哪个来源的NADH去製造ATP,却一直未有肯定答案。有些学者认为,在光合作用过程中,由叶绿体生产多馀的NADPH还原力,会以苹果酸的形式从叶绿体输出到细胞质之中,再透过线粒体膜苹果酸-草酰乙酸酯(OAA)转运体输入线粒体,经合成转化NADH予线粒体製造ATP。亦有其他学者认为,在C3拟南芥的光合作用过程中,光呼吸能生产大量NADH予线粒体作生产ATP之用,而多馀的NADH所带有的还原力,以苹果酸的形式通过苹果酸-草酰乙酸酯转运体,从线粒体输出到细胞质之中。因此这个问题在科学界一直没有共识。
该研究将两种新颖的传感器导入拟南芥,用于实时测量光照後植物细胞不同亚细胞空间的NADPH水平以及NADH/NAD+比率的动态变化,并且研究发现光合作用期间,光呼吸会向线粒体提供大量的NADH,超过了线粒体消散NADH作生产ATP能力。因此,多余的NADH必须通过线粒体的苹果酸-草酰乙酸酯转运体从线粒体输出苹果酸到细胞质中,继而会在细胞中累积(见下图),揭示了叶绿体和线粒体在光合作用过程中的能量输送,有助将来提高植物光合作用的效率。
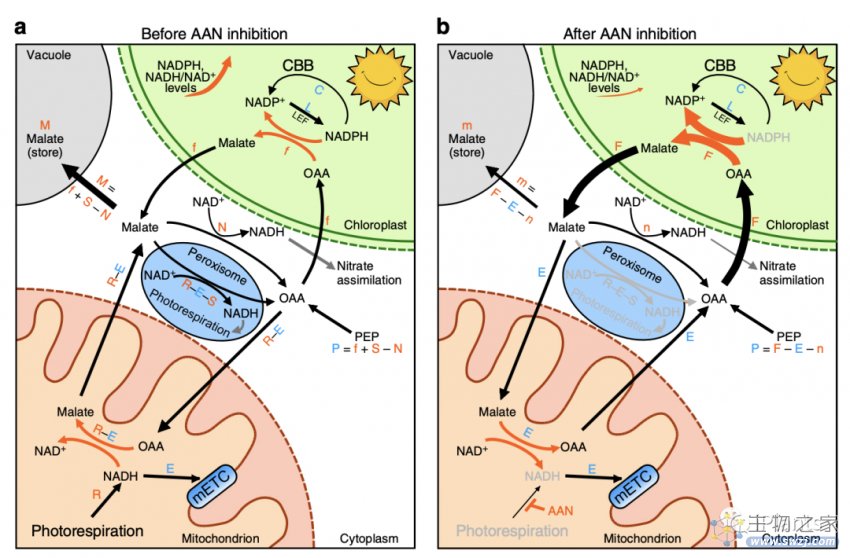
图.光合作用时苹果酸在叶肉细胞的生成和流动
论文链接:https://www.nature.com/articles/s41467-020-17056-0
02
2020年8月13日,The Plant Cell杂志在线发表了来自德国明斯特大学Markus Schwarzländera课题组题为“In Vivo NADH/NAD+ Biosensing Reveals the Dynamics of Cytosolic Redox Metabolism in Plants”的研究论文,该研究同样采用一种新的体内NADH/NAD+生物传感器技术方法,使能够实时监控环境变化(例如光,温度,干旱,洪水或害虫侵扰)对植物代谢的影响。

该研究在植物内部表达了一种基因编码的传感器,其可以直接结合释放NAD +和NADH分子。传感器由一种荧光蓝绿色蛋白和一种红色蛋白组成,它们都根据细胞中NAD的状态而改变其亮度。此外,该研究除了能跟踪氧化还原代谢的动态变化外,还可以在活植物中观察到从特定的细胞器到单个细胞,甚至整个器官的NAD +水平。因此,该研究创建整个植物的第一个NAD氧化还原图,并观察从亮到暗过渡以及糖状态,细胞呼吸和氧气供应变化的氧化还原动态。
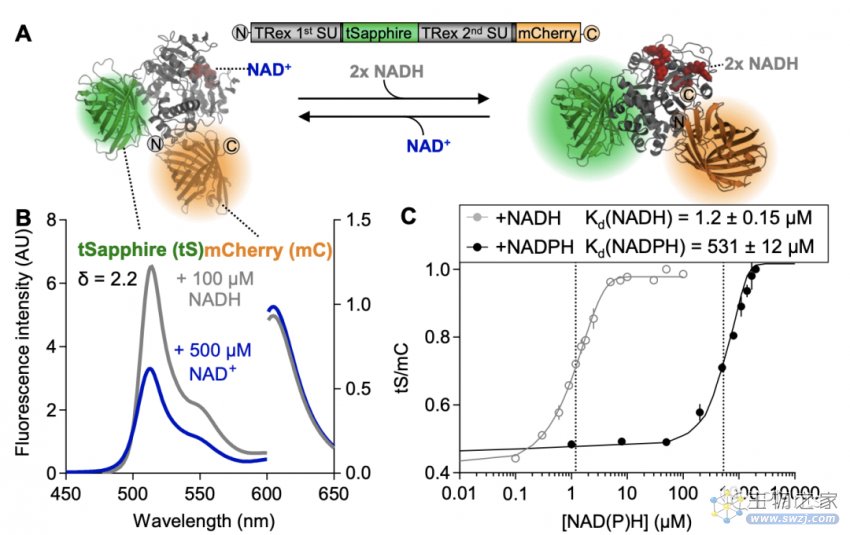
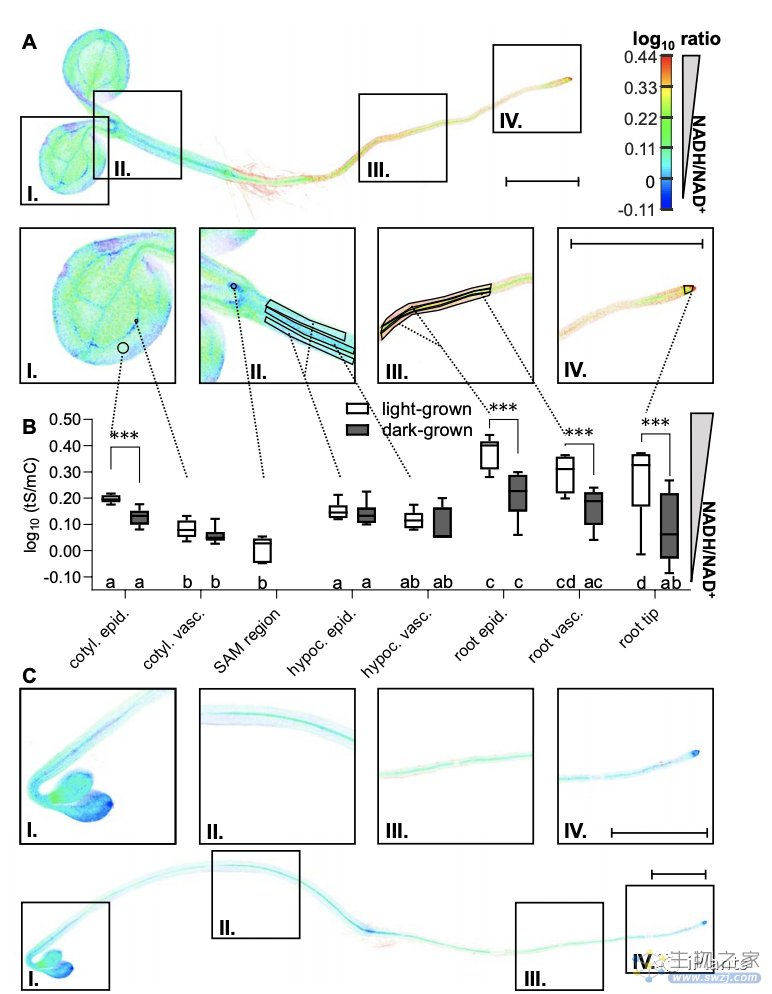
论文链接:http://www.plantcell.org/content/early/2020/08/13/tpc.20.00241
03
2019年8月26日,Nature Plants杂志在线发表了来自南京农业大学章文华课题组题为“Tissue-specific accumulation of pH-sensing phosphatidic acid determines plant stress tolerance”的研究论文。该研究通过开发脂质磷脂酸PA的生物传感器PAleon,并揭示其信号与细胞pH动态相结合,介导植物对盐胁迫的反应!

在该研究中开发了一种PA特异性光遗传学生物传感器PAleon。该方法基于Förster共振能量转移(FRET)报告质膜上生物活性PA的浓度和动态。
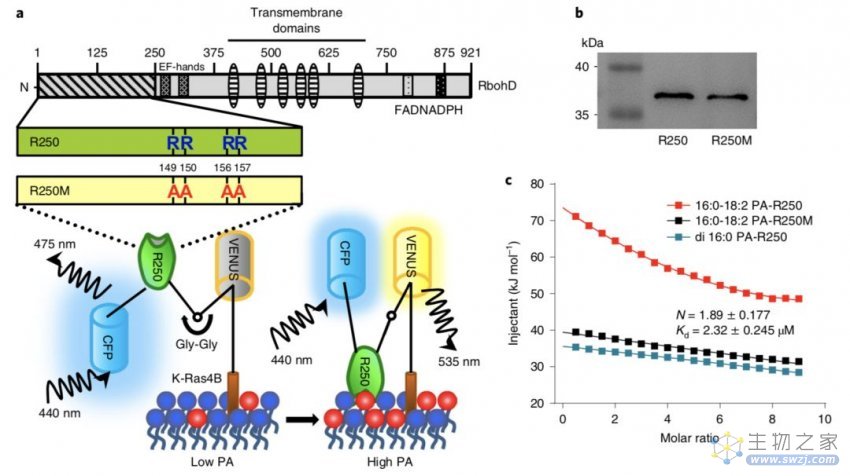
图. PAleon的设计
研究表明,PAleon足够敏感,可以监测活细胞中PA的生理浓度,并在用脱落酸(ABA)和盐胁迫处理时可视化组织中亚细胞分辨率下的PA动态。PAleon生物成像揭示了盐胁迫引发的PA积累的动力学和组织特异性。与野生型拟南芥相比,缺乏磷脂酶Dα1(PLDα1)的pldα1突变体对PA产生表现出延迟和减少的PA积累。野生型和pldα1突变体的比较分析表明,细胞pH调节PA与靶蛋白的相互作用和PLD / PA介导的盐耐受性。 因此,PA生物传感器PAleon的应用揭示了植物组织中特定的时空PA动态。同时还表明,PA信号通路与细胞pH动态相结合,介导植物对盐胁迫的反应。
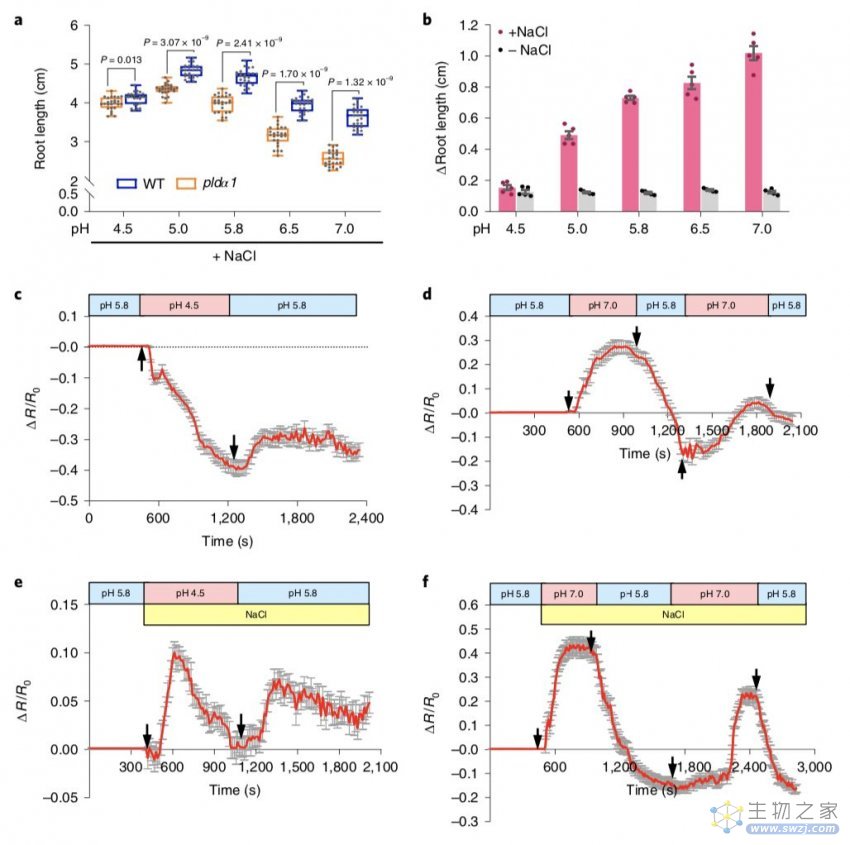
图. 盐胁迫中PA与pH均衡的相互关系
论文链接:https://www.nature.com/articles/s41477-019-0497-6
04
2020年4月15日,Nature Plants杂志在线发表了来自美国麻省理工大学Michael S. Strano课题组题为“Real-time detection of wound-induced H2O2 signalling waves in plants with optical nanosensors”的研究论文。该研究开发了一种基于H2O2选择性单壁碳纳米管(SWNT)为基础的纳米传感器,该探针在模型植物和非模型植物中能对伤口诱导的H2O2信号传导途径进行非破坏性和实时的研究。

当前技术来研究H2O2信号动力学主要局限于使用荧光染料和组织化学试剂。然而,这些方法通常对植物具有破坏性难以应用于叶片,同时,还需要较长的温育时间并且与H2O2发生不可逆反应,因此,不可能做到实时监测植物天然状态下的H2O2信号传导。
该研究串联使用一对DNA包裹的SWNT(单壁纳米管)探针作为体内检测内源性H2O2 的比率来测定植物内信号变化。体外实验表明,包裹在ss(GT)15寡核苷酸中的SWNT(以下称为G-SWNT)的荧光强度在H2O2存在下被淬灭,从而促进了它们作为活性传感器的应用。另一方面,包裹在ss(AT)15寡核苷酸(以下称为A-SWNTs)中的SWNT物种的荧光信号对于H2O2保持不变,从而使其能够作为参考。此外,传感器对H2O2的响应是可逆的,如随后添加过氧化氢酶所示,该过氧化氢酶可将H 2 O 2分解为H2O和O2。所以,这种可逆的传感机制激发了传感器能在植物体内的应用。
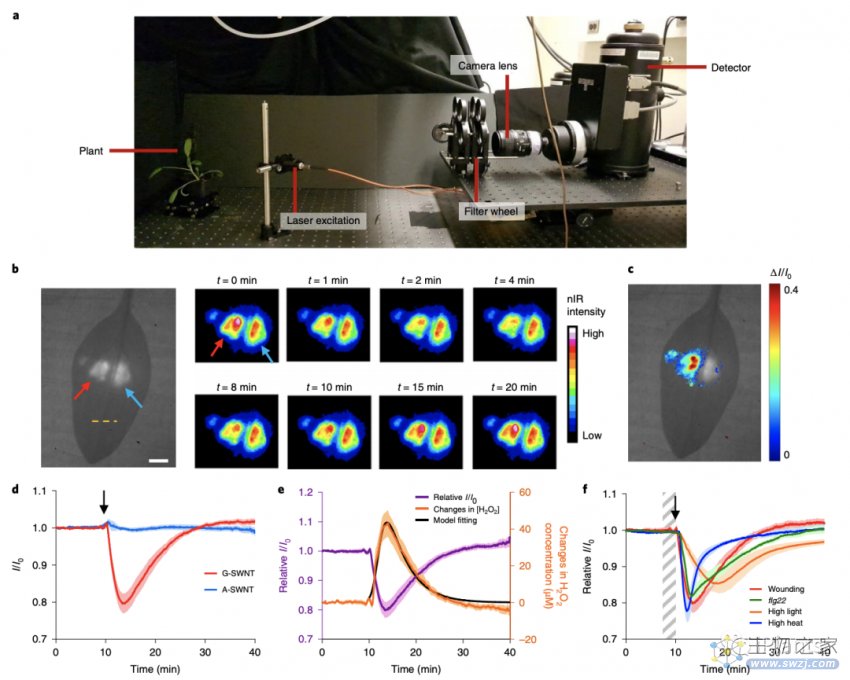
之后,该研究通过检测6种植物物种(包括生菜,Eruca sativa,Spinacia oleracea、Blitum capitatum、Rumex acetosa和拟南芥,发现受伤后的H2O2浓度分布遵循对数波形:按波速从0.44到3.10 cm/min排列,证明了这种纳米粒子介导方法的多功能性。此外,该研究表明,植物RbohD谷氨酸受体样通道(GLR3.3和GLR3.6)都是对伤口诱导H2O2波传播的关键。
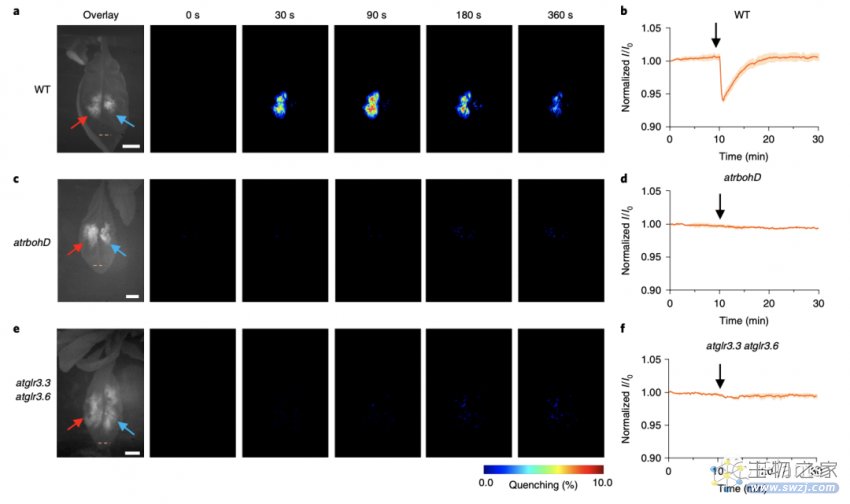
因此,该研究发现了一种新型的纳米传感器探针,该探针与物种无关,能够在植物中进行实时,空间和时间的H2O2生化测量。
论文链接:https://www.nature.com/articles/s41477-020-0632-4
05
2018年10月23日,PNAS在线发表了来自香港大学生物科学学院的林文量团队,与德国,美国及瑞典的科学家合作题为“ATP compartmentation in Arabidopsis thaliana revealed by fluorescent protein sensing”的研究论文。该研究利用转基因技术把能够量度ATP含量的荧光蛋白,导入模式植物拟南芥叶绿体及细胞质中,以实时监测植物体内的ATP浓度变化。

1969年,著名植物科学家兼《植物生物化学》教科书作者H.W Heldt教授,通过放射性定量方法证明了ATP可自由地跨过成熟的叶绿体膜。然而事实是否真正如此?
该研究将荧光ATP传感器引入到拟南芥的细胞质和叶绿体中以进一步研究这个问题。研究发现发现幼苗中的叶绿体和细胞质中的ATP浓度相近。但是,当幼苗长大时,叶绿体中的ATP浓度会明显下降,而细胞质中的ATP浓度远高于叶绿体中ATP的浓度。意味着植物限制成熟叶绿体输入细胞质ATP,因为在发育的早期阶段,未成熟的叶绿体需要吸收外源的ATP来进行生物合成。当叶绿体充分发育并能够自我维持时,需通过下调ATP转运蛋白的表达,来保证白天通过光合作用产生的能量不会在晚上被叶绿体消耗尽。

图中红色和绿色的部分显示含有ATP蛋白感受器的3天大幼苗,在470 nm – 507 nm和526 nm – 545 nm波长下的影像。左下图显示了这红绿影像之间的比率,代表了ATP的浓度(红色代表高浓度,绿色代表低浓度)。右下图显示同一幼苗的白光图像。
论文链接:https://doi.org/10.1073/pnas.1711497115































