导语:对于艾滋病,我们已经有了在病毒暴露后的紧急阻断药,可以阻断病毒在淋巴结中的大量复制和扩散到全身,因此能够大幅降低艾滋病感染的风险。而新冠病毒在侵入人体后进入大规模复制阶段前也需要一定时间,那么,能否在此之前将病毒消灭在呼吸道中?斯坦福大学研究团队通过探明新冠病毒感染呼吸道的分子水平上的详细过程,提出了这样的可能性。
2020年9月,The New England Journal of Medicine发布了电子显微镜下新冠病毒感染呼吸道上皮细胞的震撼图像。对图像着色后,可以看到,粘液链(黄色)附着在纤毛(蓝色)上,大量由人类气道上皮细胞产生的新冠病毒粒子(红色)自受感染的宿主细胞释放到呼吸道表面,已具备完整的、具有传染性的病毒形式。该图像展示了人类呼吸系统内每个细胞产生和释放的病毒粒子的数量之多,解释了病毒感染传播到受感染个体多个器官以及向他人高频率传播的源头所在。
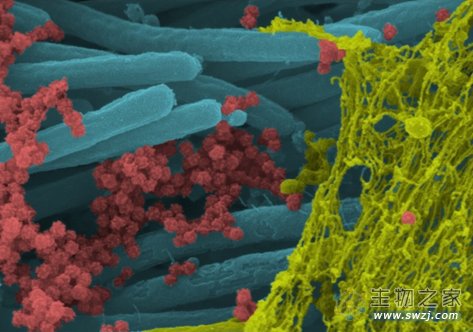
图1 着色后的电镜图(图源:[1])
通过在组织培养中模拟病毒复制,我们已经知道,新冠病毒通过其表面的刺突蛋白(S蛋白)与宿主细胞膜上ACE2受体结合,并在TMPRSS2蛋白酶的参与下,穿透到宿主细胞内部开始复制。然而,作为病毒在人体中的初始感染目标及主要复制部位,上呼吸道并非毫不设防。
鼻子和气道的上皮组织主要由三种细胞类型组成:多纤毛细胞、基底细胞和产生粘液的杯状细胞。纤毛和与其同层的粘蛋白分子(mucin)、以及其上层的粘液(mucus)共同组成粘液纤毛运输系统,粘蛋白分子彼此链接形成了一张类似三维弹性栅栏的网络阻止较大的病毒颗粒进入(~100 nm),粘液可以捕获病毒颗粒,而不断跳动的纤毛则可以推动粘液层向咽喉移动,这是一道先天的防御屏障。那么,新冠病毒是如何越过这道屏障并自由进出气道内壁细胞的呢?
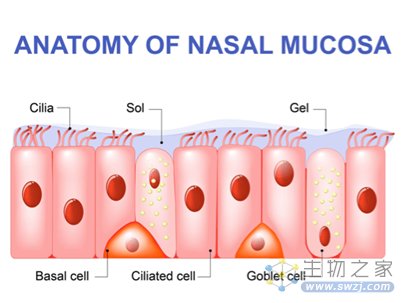
图2 鼻上皮组织构成(图源:[2])
为了回答这个问题,斯坦福大学病理学、微生物学和免疫学医学教授Peter Jackson博士及其同事通过复杂方法将人鼻黏膜上皮细胞(human nasal epithelia,HNE)分化为能模拟正常人气道结构和功能的鼻上皮类器官,虽然缺乏血管和免疫细胞,但包括了完整的粘液-粘蛋白层和发育良好的多纤毛细胞。通过在培养皿中给这些类器官接种新冠病毒,研究人员密切监测了上皮细胞中病毒进入、复制、退出的全过程,发现多纤毛细胞上的两种结构——纤毛和微绒毛——在其中起到关键作用。研究结果以“SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming”为题于2022年12月1日发表于Cell。

图3 研究成果(图源:[3])
结果发现:
1、纤毛是感染初期新冠病毒在鼻上皮细胞的主要进入部位
电镜显示病毒最初只附着在纤毛上。即使在接种 24 小时后,仅少数细胞呈病毒阳性,病毒的大规模复制发生在48小时后,表明最初受感染的细胞极为有限,而病毒的子代复制及传播到邻近细胞较为快速。

图4 病毒颗粒附着于纤毛(图源:[3])
通过敲除特定基因阻断纤毛组装发现,在24小时及48小时时抑制了HNE的新冠病毒感染。这种方法同样能够抑制副流感病毒(PIV)、呼吸道合胞病毒(RSV)的感染,表明纤毛广泛参与呼吸道病毒的感染。
改变病毒的接种水平(即感染复数,multiplicity of infection,MOI),病毒的进入和扩散模式未发生变化。研究人员猜测是粘蛋白网络阻止了病毒的感染。使用特定的蛋白酶破坏粘蛋白网络结构,确实增加了24小时时病毒的进入。
在那些纤毛运动障碍患者的细胞培养的类器官中,病毒在48小时后感染的细胞比正常情况下区域更为局限。该运动障碍将使得粘液无法受纤毛推动而流动,这说明病毒正借助了粘液的流动传遍了整个上呼吸道。
ACE2受体是新冠病毒进入细胞的关键,在纤毛上病毒同样与ACE2结合。随后以两种可能的方式穿越粘液-粘蛋白屏障:1)病毒与ACE2结合,TMPRSS2促进病毒融合,RNA基因组随后释放到纤毛中,并通过纤毛动力蛋白转运到胞质溶胶中;2)病毒与ACE2结合形成的复合体依靠纤毛动力蛋白从纤毛远端运输到细胞体。
2、新冠病毒通过调节微绒毛结构和功能,使病毒排出
多纤毛细胞上除了较长的纤毛,还存在一种圆顶粗短的微绒毛结构。新冠病毒一旦进入细胞,将引起细胞内酶的活性,使得微绒毛像疯涨的植物一样,不断伸长分枝,形成与纤毛大小相当或更大的树状结构,而附着在其上的病毒颗粒也因此进入粘液-粘蛋白层,“随波逐流”感染更远的细胞。
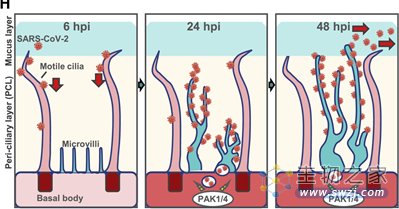
图5 PAK1/4激酶调节微绒毛以促进新冠病毒的出芽和传播(图源:[3])
研究人员确定了其中起到关键作用的调节激酶。使用特定的激酶抑制剂并不影响早期病毒进入细胞,但在48小时时病毒排出期,减少了病毒阳性细胞的数量。对小鼠使用鼻腔喷雾的动物实验的结果也表明,激酶抑制剂能够部分抑制感染。
以上发现确定了鼻腔用药的新靶点,可通过阻止纤毛运动或微绒毛生长,防止呼吸道病毒在鼻子中“殖民扩张”。Jackson博士表示,实验中使用的药剂可以进一步优化,比如制成用于呼吸道病毒暴露后不久使用的鼻腔喷雾剂,或是预防药物,“使用局部用药的短时药物来延迟病毒的进入、排出或扩散,将帮助我们的免疫系统及时赶到,阻止全面感染。这将有望限制未来的疫情大流行。”
参考资料:
[1]https://news.unchealthcare.org/2020/09/unc-researchers-publish-striking-images-of-sars-cov-2-infected-cells/
[2]https://www.integrativepro.com/articles/snot-closer-look-at-nasal-mucus
[3]Wu CT, Lidsky PV, Xiao Y, et al. SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming. Cell. 2023 Jan 5;186(1):112-130.e20. doi: 10.1016/j.cell.2022.11.030.































