自然界中很多动物,尤其是低等动物具有强大的再生能力。比如,章鱼的触腕断掉之后不久也可以重新长出,然而,包括人类在内的很多高等哺乳动物在失去肢体后却难以重新再生。
对于人类而言,肝脏具有部分再生能力,切除后会逐渐生长到原来大小,然而除了肝脏之外,其他器官的再生能力非常有限。
长期以来,围绕再生医学领域的研究热度始终居高不下,如何实现人类肢体和器官再生也一直是困扰医学界的重大挑战。

近期,来自西北工业大学、 吉林农业大学、第四军医大学以及中国科学院动物进化与遗传卓越创新中心等多个科研机构的研究人员,联合开展了一项关于哺乳动物器官再生的研究,发现鹿角胚芽祖细胞(ABPCs)可能是高等脊椎动物保守再生细胞的来源,为进一步探索哺乳动物的器官再生提供了遗传与组织学理论基础。
目前,这项研究已经以“A population of stem cells with strong regenerative potential discovered in deer antlers”(在鹿角中发现具有强大再生潜能的干细胞群)为题发表在 Science 上。
(来源:Science)
研究人员表示,围绕临床方面,这些新发现可以应用于临床骨骼修复,并且随着关键特征基因的激活,其还有可能用于骨骼、长骨或肢体再生的再生医学领域。
西北工业大学生态环境学院王文教授、邱强教授,长春科技学院鹿茸科学与产品技术研究所李春义教授,第四军医大学西京医院黄景辉教授等为该论文的共同通讯作者。
值得一提的是,王文教授是今年 1 月公布的“新基石研究员”生物与医学科学领域的 28 位科学家之一。王文于 1989 年获武汉大学学士学位,1996 年获得中国科学院博士学位,现为西北工业大学二级教授、博士生导师,同时,他也是国家杰出青年基金获得者、国家创新研究群体首席科学家,以及“国家自然科学二等奖”获得者。
王文长期从事进化遗传学和进化基因组学研究,在新基因及其功能起源机制,以及生物基因组进化和生物大数据分析挖掘方面取得了一系列受到国际同行关注的成果。
01
揭示 ABPCs 为哺乳动物肢体再生细胞来源
在动物界,似乎动物越高等,再生能力就越弱。比如先前的一项研究发现涡虫在被切成 279 块后,每小块仍能够再生为独立的新个体,拥有强大的再生能力。
相较之下,蚯蚓的再生能力稍弱,其被切成两段同样可以分别存活,然而切的段数越多,再生为独立个体的几率就越小,其再生能力具有极限。而蝾螈则可以重建器官、四肢、脊髓以及缺失的脑组织,其他的诸如壁虎再生断尾、斑马鱼再生鱼鳍等。
聚焦到哺乳动物层面,它们很大程度上已经丧失了再生肢体或器官的能力,然而,鹿却是一个例外。鹿角每年都能够进行周而复始的“再生”,是哺乳动物中鲜有的、可在自然条件下周期性再生的器官,因此鹿角再生为研究哺乳动物器官再生机制提供了一个非常有价值的模型。
“作为哺乳动物,鹿依然能够以常规和可靠的方式进行‘再生行为’。”研究人员在文中指出,“雄鹿的鹿角每年都会作为活组织进行再生,血管和神经包裹在快速生长的骨骼结构周围。”
随后,他们基于鹿角再生过程中开展研究并发现了一种“胚芽样结构”,其类似于两栖动物肢体再生过程中涉及的结构,这表明哺乳动物组织再生具有一种保守的生物学特征。
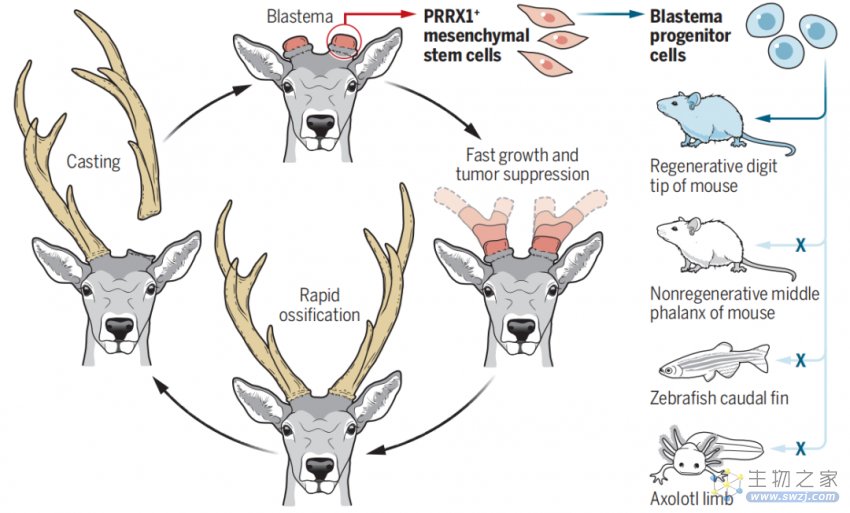
▲图|鹿角胚芽祖细胞驱动器官再生(来源:Science)
鹿角胚芽中表达配对中胚层同源盒蛋白 1(PRRX1)的间充质干细胞产生鹿角胚芽祖细胞(ABPCs),这类细胞能够直接促进鹿角再生,此外,ABPC 样细胞似乎也存在于处于再生过程中的哺乳动物器官中,但不存在于哺乳动物非再生组织,以及蝾螈和斑马鱼的再生组织。
除了鹿,小鼠也具备有限的肢体再生能力,比如它们可以再生前脚趾尖。研究团队在一项跨物种的研究中对比发现,在鹿角胚芽样结构中发现的再生祖细胞也存在于小鼠再生的脚趾尖,然而在非哺乳动物物种却没有这类细胞,即这些基因不同于在蝾螈肢体或斑马鱼鳍中发现的基因。对此,研究人员表示,“鹿和小鼠这两种已知的再生能力案例都存在相对保守的细胞和分子机制,这表明哺乳动物可能具有独特的再生机制。”
为了全面记录鹿角再生过程中的基因转录动力学和细胞类型变化,研究团队采用单细胞 RNA 测序技术对不同再生阶段的鹿角进行分析,并通过体内/体外试验对关键干细胞群的功能进行评估。
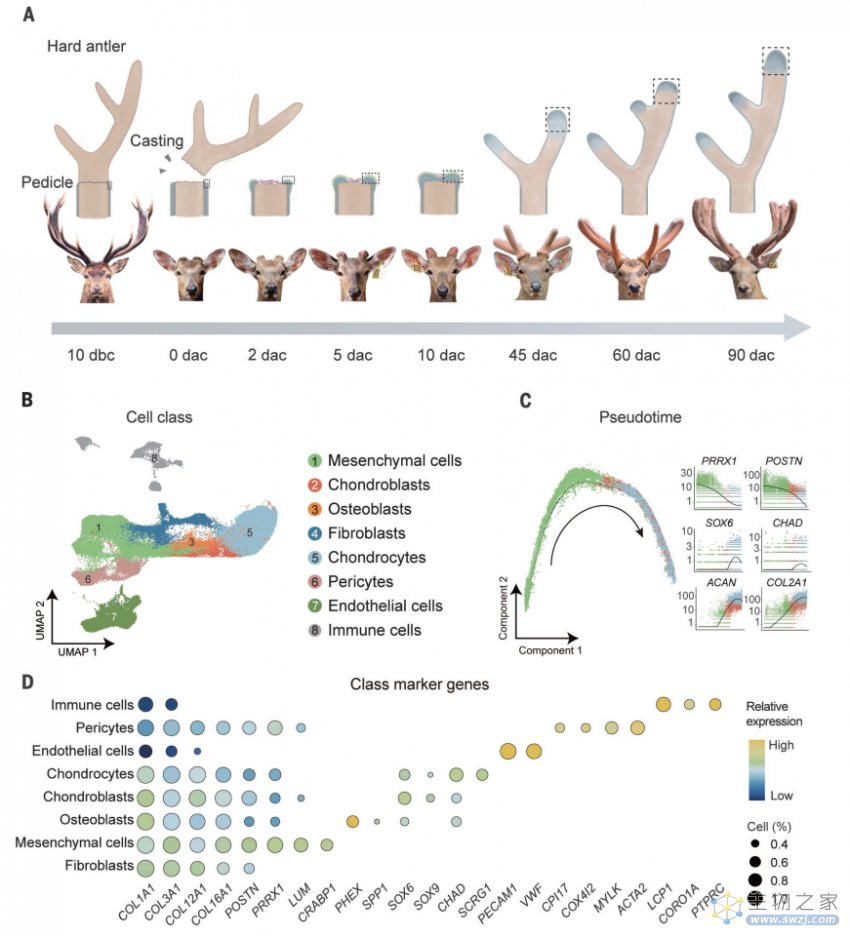
▲图|鹿角再生的发育细胞图谱(来源:Science)
在对涉及鹿角再生关键阶段的 74730 个细胞进行分析后,他们将样本细胞划分为 8 种细胞群,其中鹿角胚芽中表达 PRRX1 的间充质干细胞在样本中的数量较多,由其分化而来的 ABPCs 驱动鹿角的再生过程。
既然这些细胞能够让鹿实现鹿角再生,其能否让其他动物也长出鹿角呢?随后,他们基于小鼠模型开展试验以测试这些细胞的作用。
在把鹿角胚芽祖细胞移植到小鼠头部后,发现小鼠头盖骨上出现了鹿角状骨的软骨结构,这些软骨结构并非来自小鼠局部组织,而是完全由来自移植的鹿角胚芽祖细胞生长出来的,表明这些细胞具有异位发育为鹿角的潜力。
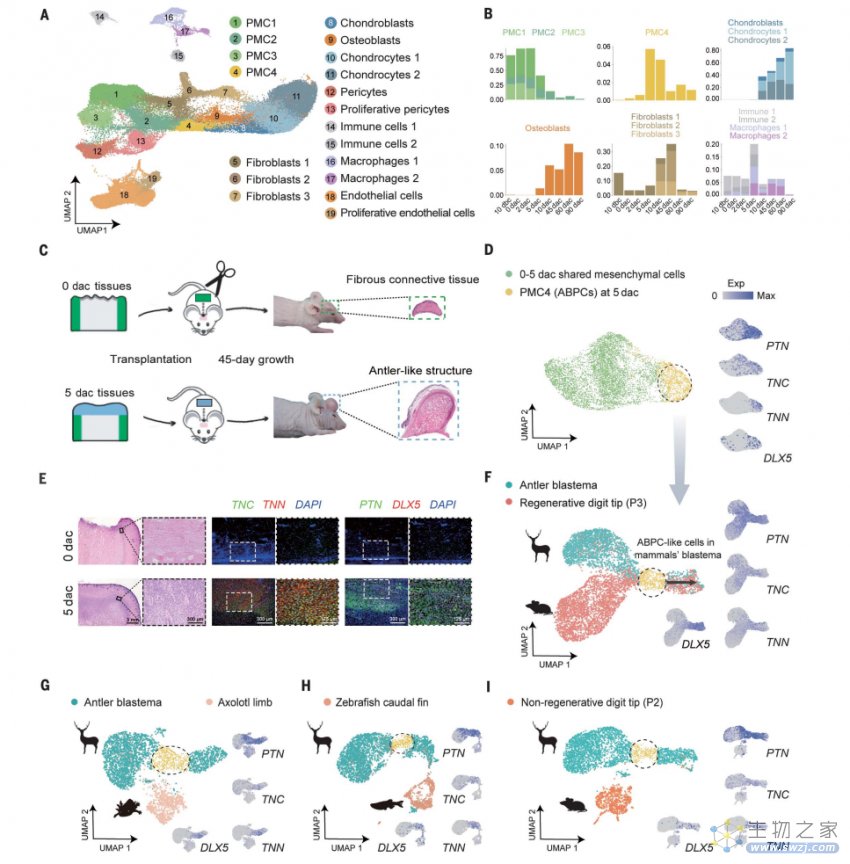
▲图|鹿角再生的细胞动态图谱和关键再生祖细胞的鉴定(来源:Science)
总的来说,他们在这项研究中详细地描绘了鹿角再生的细胞发育图谱,系统地阐述了鹿角再生的细胞分子机制,发现了鹿角再生过程中发挥关键作用的一类特有干细胞群(ABPCs),为今后临床再生医学骨骼修复与再生提供理论基础。
02
来自 ABPCs 的外泌体或更具临床应用潜力
探索哺乳动物的肢体和器官如何实现再生,对于今后研究组织器官损伤修复以及抗衰老具有重要意义,先前的很多研究大都围绕蝾螈、斑马鱼等低等动物展开,针对哺乳动物中的肢体再生机制缺乏深入探索。
围绕鹿角再生领域,先前的研究主要集中于再生过程中的形态学和组织学,并揭示了在鹿角快速生长发挥关键作用的一些基因、调控元件等,而关于鹿角再生细胞图谱和分子机制尚不明确,该研究填补了针对哺乳动物再生机制探索的一项空白。
就在这篇论文发表的同期,中国农业科学院特产研究所王大涛教授等也在 Science 上就这项研究发表了一篇点评文章。
(来源:Science)
王大涛在文中表示,在肢体丢失后会产生一群被称为胚芽祖细胞的未分化细胞驱动肢体再生,这项研究揭示了鹿角胚芽祖细胞(ABPCs)具有强大的自我更新、成软骨分化和骨组织修复的潜力,这些发现补充了胚芽祖细胞是哺乳动物肢体再生过程中常见的干细胞类型的新观点。
在王大涛看来,鹿角是一个很好的案例,其再生是一个基于干细胞的再生过程,它们每年都表现出完整的形态、结构和功能再生,这与损伤后的代偿性再生有所不同。另外,鹿角再生还有一个显著特征是再生速度方面,鹿角每天可以长 2.75 厘米,并且在 3 个月内可以达到 15 千克重和 120 厘米长。
除此之外,由于鹿角是骨骼,因此对鹿角成骨的研究可能对于骨损伤修复和骨质疏松症的研究具有重要意义。与此同时,尽管在动物模型中展现出功效,但若是将 ABPCs 直接注射到人类体内,可能会引起免疫排斥并引发伦理问题,因此,来自 ABPCs 的外泌体可能更适合于临床治疗方面的发展。值得注意的是,外泌体的功能和组成需要进行进一步验证。
围绕这项研究,王大涛也指出,更深层次的研究还需要关注鹿角如何实现如此快速的生长速度,这种持续的增殖是否可以延缓衰老或在组织修复中对抗衰老,以及在鹿角中实现抗肿瘤作用的机制是什么。
参考资料:
1.https://www.science.org/doi/10.1126/science.add0488
2.https://www.science.org/doi/10.1126/science.adg9968
3.https://phys.org/news/2023-03-regenerating-bone-deer-antler-stem.html































