近年来,癌症领域的多项突破性研究使各种类型的癌症患者受益匪浅,但脑胶质瘤的预后仍然较差,治疗方案也相对有限。这种困境的原因之一是该疾病的病因不明。目前,唯一确定的脑瘤环境风险因素是电离辐射照射。
2002年以来,有研究团队报道了脑胶质瘤中存在人巨细胞病毒(HCMV)的DNA和蛋白质的证据。罗敏华团队前期研究表明HCMV的DNA和即刻早期蛋白IE1/2与胶质瘤的预后高度相关。多个团队报道了抗HCMV的干预能提高胶质瘤患者的生存期。这提示HCMV在胶质瘤发病机制中的重要作用,但HCMV如何感染胶质瘤细胞的分子机制尚不清楚。
近日,中国科学院武汉病毒研究所/病毒学国家重点实验室罗敏华团队联合复旦大学附属上海市公共卫生临床中心程汉团队、广州市妇女儿童医疗中心、武汉脑科医院,在 PLOS Pathogens 期刊发表了题为:SOX2 downregulation of PML increases HCMV gene expression and growth of glioma cells 的研究论文。
该研究揭示了人巨细胞病毒(HCMV)感染脑胶质瘤细胞的关键分子机理,并在动物模型中发现了HCMV促进胶质瘤细胞生长,为临床上SOX2/IE1的高表达与胶质瘤患者预后不佳相关提供了科学解释。

该研究鉴定到胶质瘤干细胞标志物SOX2是HCMV感染胶质瘤细胞的关键决定宿主分子。研究显示,SOX2负调控宿主抗病毒防御反应信号通路,并下调多个参与拮抗HCMV感染的干扰素刺激基因,从而促进HCMV在胶质瘤细胞的基因表达。其中,SOX2通过抑制PML核体(promyelocytic leukemia nuclear bodies,PML NBs)的主要组成部分PML和Sp100的表达来促进HCMV的感染。
该研究进一步建立了异种移植的人原代胶质瘤小鼠模型验证SOX2-PML轴对HCMV感染的调节作用。在植入的人原代胶质瘤细胞中过表达SOX2会增强HCMV感染和肿瘤增殖能力;提高PML的表达则可削弱SOX2的促感染/促瘤效应。该团队在胶质瘤患者中检查了这些分子的表达情况,发现SOX2的水平与IE1呈正相关,但与PML和Sp100的水平呈负相关,这支持了SOX2下调PML促进胶质瘤中的HCMV感染这一假说。
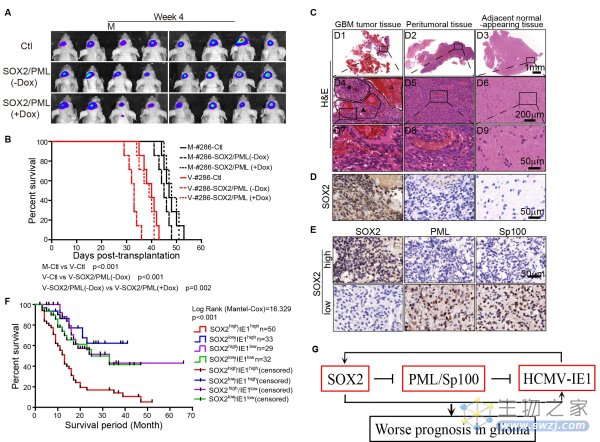
SOX2介导HCMV感染并调控胶质瘤细胞生长的分子机制
动物模型结果和临床数据分析表明,胶质瘤中的HCMV感染可能促进肿瘤的生长并使结果恶化,具有重要临床意义,即SOX2/IE1的表达可用于预测胶质瘤患者的预后,而SOX2-PML轴可能是新疗法开发的新目标。
论文链接:https://doi.org/10.1371/journal.ppat.1011316































