阿尔茨海默病(Alzheimer's disease, AD),俗称“老年痴呆症”,是一种严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。目前,全球约有5000万人罹患阿尔茨海默病。随着人类平均寿命增长,老年化社会加剧,阿尔茨海默病的患病率也在不断上升,预计到2050年,阿尔茨海默病患者将增加至1.5亿以上。
仅在中国,65岁以上人群中阿尔茨海默病的发病率是5%,且每增加10岁,发病率就增加5%。也就是说,在85岁的人群中,每2-3个高龄老人就有一个是阿尔茨海默病患者,这对家庭、社会造成巨大负担。
免疫疗法是目前有希望治疗阿尔茨海默病(Alzheimer's disease,AD)的策略之一。然而,基于该疗法的抗体药物开发却在临床试验中屡屡失败。因此,揭示抗体药物治疗阿尔茨海默病失败的原因,对于后续药物研发和患者治疗至关重要。
近日,中国科学院过程工程研究所研究员刘瑞田团队在 Signal Transduction and Targeted Therapy 期刊发表了题为:Fc effector of anti-Aβ antibody induces synapse loss and cognitive deficits in Alzheimer’s disease-like mouse model 的研究论文。
刘瑞田团队经过多年研究,发现了阿尔茨海默病抗体药物介导神经突触过度丢失是导致免疫治疗失败的原因。研究团队进一步提出了无效应片段(Fc段)或无效应功能的β-淀粉样蛋白(Aβ)抗体具有较好的AD治疗前景这一新策略。

神经突触是构成神经回路、产生记忆和神经活动的重要基础。小胶质细胞作为中枢神经系统中的固有免疫细胞,其正常生理功能之一在于补体依赖性地识别并吞噬低活性的神经突触、参与神经突触发育调节和导引认知相关的突触可塑性。Aβ聚集形成的毒性寡聚体(Aβ寡聚体)是AD的主要致病因素。该寡聚体与神经突触之间极易结合,导致神经突触功能紊乱和损伤,从而诱发小胶质细胞对其吞噬清除。神经突触的大量丢失导致认知功能损伤,是AD患者记忆力下降的主要原因。
研究团队基于对啮齿类动物原代神经细胞和AD转基因动物模型的研究发现,在AD免疫治疗过程中,靶向Aβ的全效应抗体可特异结合神经突触上的抗原——Aβ寡聚体,继而激活补体系统,诱使小胶质细胞以类似生理性的突触修剪机制,对抗原-抗体-补体复合物连同神经突触进行过度吞噬,造成AD患者神经突触的大量丢失和认知功能进一步破坏,导致AD免疫治疗失败。而无Fc段或无效应功能的Aβ抗体由于不会激活补体级联反应,则不会诱导这种急性突触清除和认知损伤。
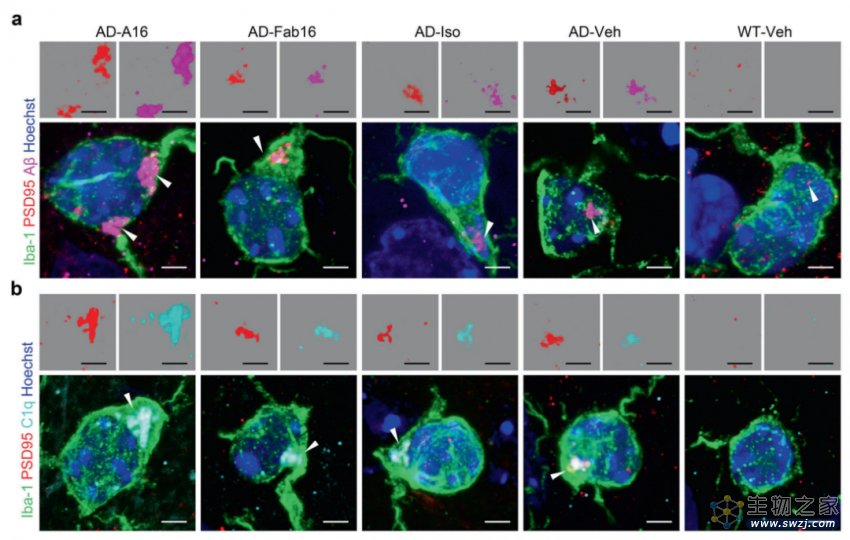
全效应抗体A16显著促进AD小鼠脑内小胶质细胞吞噬神经突触
同时,科研团队分别在人源和鼠源神经干细胞诱导分化的神经元细胞水平上,对二者的神经突触再生速度展开对比研究,发现人的突触再生速度低于小鼠,这解释了AD免疫制剂在动物实验中表现良好,却在临床试验中屡遭失败的原因。该机制为AD免疫治疗新药的设计和研发提供了指导,并可对其他中枢神经系统疾病的免疫治疗研究提供帮助。
论文链接:https://www.nature.com/articles/s41392-022-01273-8































