提起「果糖」,大家并不陌生。果糖是单糖的一种,是葡萄糖的同分异构体。天然果糖以游离状态大量存在于水果、蜂蜜以及一些根茎类的蔬菜中,水果的甜味大多源自果糖。
果糖的甜度较高,室温下约为葡萄糖的2倍,是蔗糖的1.7倍。但和葡萄糖不同,果糖不会造成血糖的大幅度提升,升糖指数仅仅20,这难道不是妥妥的低GI食物吗?
最开始,人们也是这么认为的。甜度高、口感好、低GI,于是工业上开始“大刀阔斧”地生产和使用。
随着食品工业的不断发展,1970年果糖的生产技术取得突破,果糖摇身一变成为工业中的“果葡糖浆”,并被大量生产和用于食品加工行业。目前来看,果葡糖浆(即果糖),是人们爱喝的奶茶以及多数软饮料中最主要的含糖添加剂。

如果只是正常饮食,即使是按照推荐的最大量来吃水果,日常摄入的果糖量也不会构成“健康威胁”。但自从果葡糖浆的获取变得非常容易后,这些甜味剂使得果糖的总消费量增加了2倍,于是果糖的“负面新闻”也越来越多。
但近日,来自上海交通大学医学院的研究团队却有了“颠覆性”发现:膳食果糖竟然有抗肿瘤的作用!研究发现,膳食果糖能够调节脂肪细胞代谢,以增强抗肿瘤的CD8+T细胞免疫反应,发挥抑制肿瘤生长的作用。于10月19日发表在Cell Metabolism上。
该研究堪称“炸裂”,早已被人们“打入冷宫”的果糖竟有抗癌作用?难道奶茶又能喝了?到底是怎么一回事儿?

https://doi.org/10.1016/j.cmet.2023.09.011
其实,果糖摄入量与癌症发病率之间存在关联,并非新闻。但在传统认知中,高果糖的摄入会增加部分癌症的发生风险——
先前的研究发现,高果糖饮食推动了MUP-uPA小鼠模型中肝细胞癌的发生与发展;在高果糖玉米糖浆的喂养下,能够促进小鼠肠细胞的存活,改善营养吸收的同时,也加速了肿瘤的生长;此外,在结直肠癌小鼠模型中,醛缩酵素介导的果糖代谢促进了果糖转移等等。上述观察表明,果糖摄入恐增加肝细胞癌和结直肠癌的发生风险,这也与大众认知一致。
然而,美国国立卫生研究院-美国退休人员协会(NIH-AARP)的饮食与健康研究却发现了相反的结论:果糖对肺癌具有保护作用。为什么会出现这种情况呢?多吃果糖究竟是福还是祸?
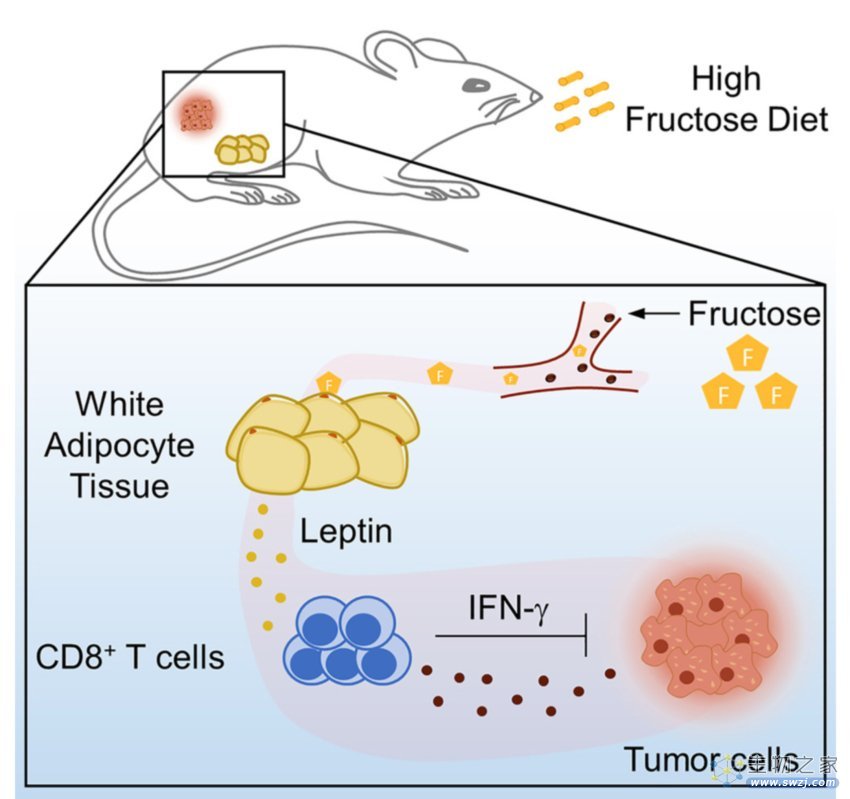
研究摘要
为了探究膳食果糖在体内抗肿瘤免疫反应的作用,研究者采用高果糖饮食或正常饮食喂养小鼠,并在喂养后第14天,用B16-F10黑色素瘤细胞去“攻击”小鼠。
结果很有意思,与正常饮食相比,喂养高果糖饮食的小鼠体内肿瘤体积更小,且存活率更高,即高果糖的喂养方式显著抑制了肿瘤生长以及其诱导的致死率。
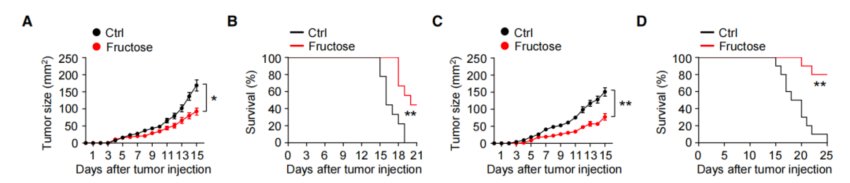
高果糖饮食组体内肿瘤更小且存活率更高
鉴于T细胞是肿瘤微环境(TME)中抗肿瘤免疫反应的主要介质,研究者将目光投向了T细胞,以探索“果糖抗肿瘤”的深层机制。
在代表CD8+ T细胞的三个群族中,高果糖饮食小鼠肿瘤内的耗竭性CD8+ T细胞(Tex)显著减少,而记忆性CD8+ T细胞(Tmem)则大幅度增加。但在缺乏成熟T细胞的基因编辑小鼠中,则未观察到与对照组之间的肿瘤生长方面的差异。
上述发现表明:CD8+ T细胞是饮食果糖发挥抗肿瘤活性中必不可少的一环——高果糖喂养能够影响肿瘤内CD8+ T细胞亚群的分化,增加CD8+ T细胞的免疫反应,从而抑制肿瘤的发展。
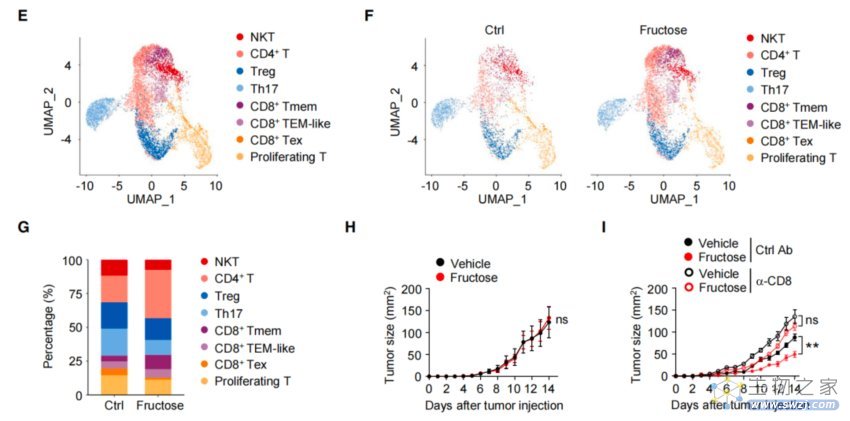
果糖能影响CD8+ T细胞,从而抑制肿瘤发展
不过,膳食果糖并非直接靶向T细胞,而是在瘦素的介导下增强了抗肿瘤T细胞反应。在分析了小鼠血清中32种免疫因子后,研究者发现,高果糖饮食组的脂肪因子瘦素水平显著升高,而瘦素具有增强TME中T细胞效应的功能。
为了验证瘦素的关键作用,研究者采用抗瘦素单克隆抗体处理了肿瘤小鼠。在中和了瘦素之后,小鼠体内的肿瘤生长加速,进而提高了肿瘤诱导的致死率,还降低了肿瘤浸润的Ki-67和IFN-g+ CD8+ T细胞的频率。
与之类似,在携带瘦素受体缺陷T细胞的小鼠中,即使给予其高果糖饮食,肿瘤体积依然增大,且肿瘤浸润的Ki-67和IFN-g+ CD8+ T细胞的频率也大大降低。也就是说,当小鼠体内缺乏生成瘦素的途径时,高果糖饮食也无法发挥抗肿瘤作用。
总结来说,膳食果糖通过增强瘦素信号,加强了抗肿瘤T细胞反应,从而发挥抑制肿瘤的作用。
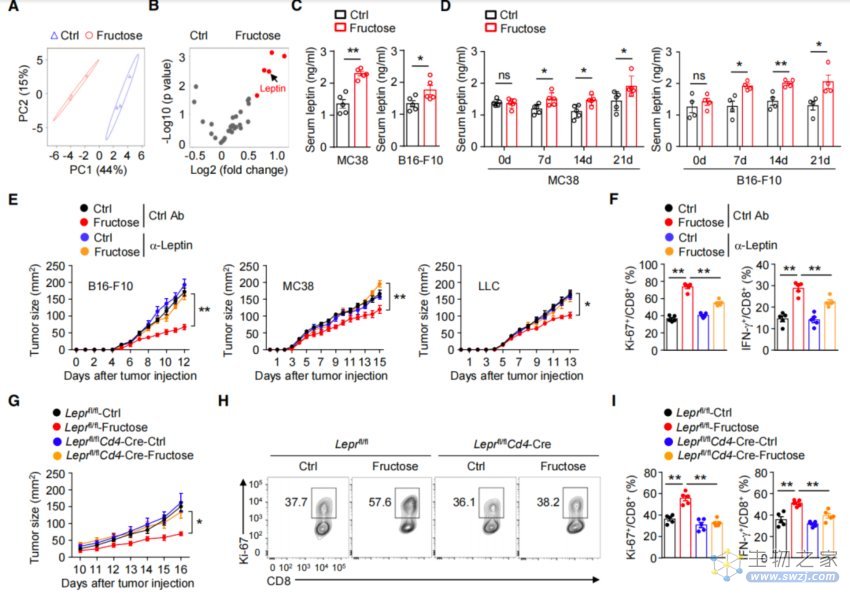
高果糖饮食介导瘦素增强抗肿瘤T细胞反应
虽然整个抗肿瘤链路已经比较清晰了,但膳食果糖为何会与瘦素之间存在关联呢?又是如何增加瘦素分泌的呢?这是研究者接下来需要探明的问题。
瘦素(Leptin)是一种重要的脂肪因子,主要由白色脂肪组织(WAT)产生。先前的研究中,研究者观察到,高果糖喂养下小鼠的附睾、腹股沟和腋窝WAT的脂肪细胞中瘦素的表达显著上调。
接着,研究者采用系统代谢组学方法监测了小鼠WAT中果糖代谢的变化。有意思的是,高果糖饮食小鼠的WAT中,磷酸二羟丙酮(DHAP)、乳酸和丙酮酸(PA)等糖酵解中间产物的水平显著升高,并激活了mTORC1信号通路。
此前有研究揭示,mTORC1复合物中的一个关键成分Raptor的缺失会影响到脂肪细胞中瘦素的表达。于是,研究者敲除了小鼠体内的Raptor,以观察mTORC1信号与瘦素之间的关联。
果然不出所料,在缺乏Raptor的情况下,小鼠脂肪细胞中瘦素的表达显著下降,即血清瘦素水平明显降低。相应的,小鼠体内肿瘤生长速度明显增加,同时肿瘤浸润CD8+ T细胞中Ki-67的表达有所降低。
也就是说,膳食果糖增加了脂肪细胞中糖酵解中间产物的水平,激活脂肪中mTORC1信号传导,从而提升了血清瘦素水平。
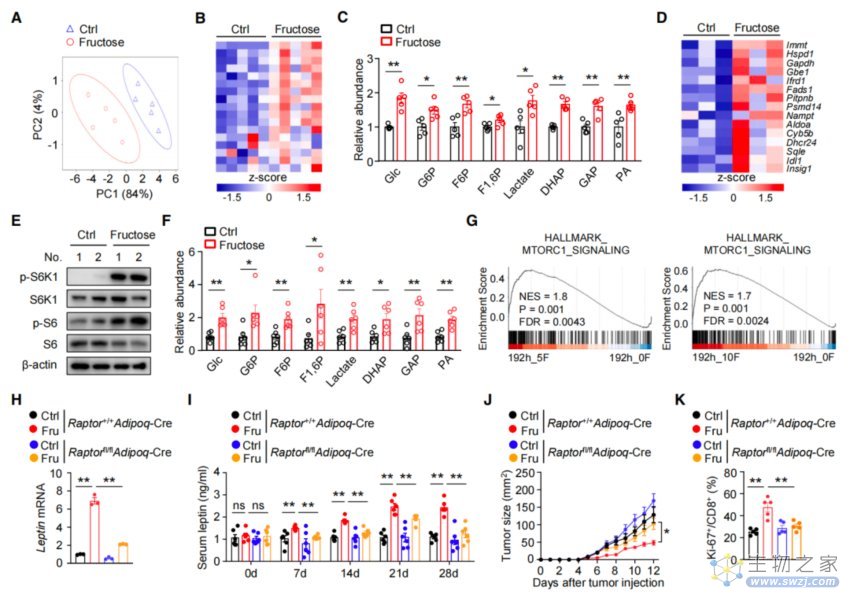
果糖诱导脂肪细胞产生瘦素依赖于mTORC1的激活
上述小鼠实验已经证明了果糖-瘦素轴在CD8+ T细胞抗肿瘤功能中存在着重要作用,那么在人类癌症患者中,果糖-瘦素轴又存在着怎样的临床意义呢?
于是,研究者分析了肺癌患者血浆中果糖和瘦素的浓度,发现:患者循环系统中的果糖浓度和瘦素水平呈正相关,即果糖浓度越高,瘦素水平越高,抗肿瘤T细胞反应可能也会随之越强。
不仅如此,肺癌患者的瘦素水平还与肿瘤浸润 IFN-g+效应CD8+ T细胞的百分比呈正相关。也就是说,血浆瘦素水平的升高,与T细胞反应增强有关。
但值得注意的是,在结直肠癌患者中没有观察到两者的相关性。
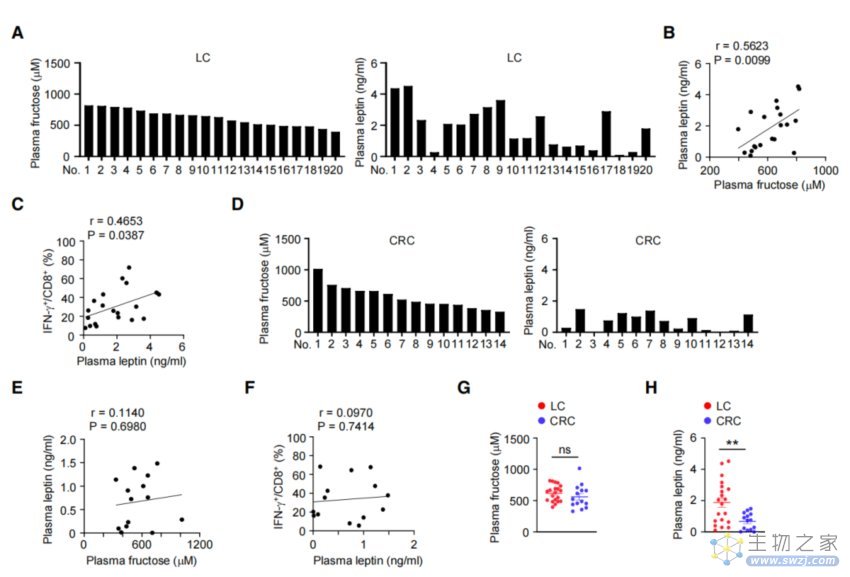
肺癌患者中的瘦素水平与T细胞反应的关联性
综上所述,膳食果糖以mTORC1依赖的方式促使脂肪细胞产生瘦素,并介导瘦素信号传导增强了CD8+ T细胞的效应功能,从而发挥抗肿瘤的作用。重要的是,研究者在肺癌患者中观察到高血浆瘦素水平与抗肿瘤T细胞反应的改善有关,表明肺癌免疫疗法中靶向果糖-瘦素-CD8+ T细胞轴是有潜力的。
不过,正如研究负责人邹强教授强调的那样:“但本研究并未证明膳食果糖是否能直接促进瘦素表达以增强CD8+ T细胞的抗肿瘤功能,因此癌症患者能否使用多摄入果糖作为辅助治疗,仍需更多的临床队列研究来证实。”
同样,本研究并非鼓励大家去大喝奶茶、大吃甜品,过度摄入果糖仍存在一定的健康风险,千万不要舍本逐末了!
参考资料:
[1]Zhang Y, Yu X, Bao R, Huang H, Gu C, Lv Q, Han Q, Du X, Zhao XY, Ye Y, Zhao R, Sun J, Zou Q. Dietary fructose-mediated adipocyte metabolism drives antitumor CD8+ T cell responses. Cell Metab. 2023 Oct 15:S1550-4131(23)00367-4. doi: 10.1016/j.cmet.2023.09.011. Epub ahead of print. PMID: 37863051.































