以免疫检查点抑制剂为代表的癌症免疫疗法改变癌症治疗格局,其中,阻断PD-1或PD-L1的抗体以及被批准用于治疗超过25种不同的癌症。然而,并非所有癌症患者都能从这些疗法中获得同样的益处,据统计,PD-1/PD-L1抑制剂在批准的适应症中的反应率根据肿瘤类型从13%-69%不等。
PD-1(程序性细胞死亡受体-1),其位于T细胞表面,而位于肿瘤细胞表面的PD-L1(程序性细胞死亡配体-1),PD-L1通过与PD-1的结合,促使肿瘤细胞获得免疫逃逸。因此,通过抑制剂来抑制PD-1与PD-L1之间的结合,能够帮助T细胞重新获得杀伤肿瘤的能力。而哈佛大学的 Gordon Freeman 教授发现,除了PD-L1(由陈列平教授发现),PD-1还有一个配体——PD-L2。
了解调节PD-1抑制剂反应性的因素,有助于制定使更多癌症患者受益的治疗策略。之前的研究表明,肠道微生物群可以调节PD-1抑制剂在癌症中的疗效。这些发现刺激了益生菌和粪便移植研究,以促进PD-1免疫治疗的抗肿瘤反应。
近日,哈佛大学 Gordon Freeman 教授、Dennis Kasper 教授和 Arlene Sharpe 教授等在 Nature 期刊发表了题为:Targeting PD-L2–RGMb overcomes microbiome-related immunotherapy resistance 的研究论文。
该研究发现并证实了肠道微生物通过下调PD-L2和RGMb以促进抗肿瘤免疫反应,并鉴定了介导这种作用的肠道细菌——C. cateniformis。特定肠道细菌通过影响PD-L2和RGMb的活性以及它们之间的相互作用,从而在癌症免疫治疗中发挥关键作用。这也证明了PD-L2-RGMb是一个此前未知的帮助癌细胞逃逸免疫系统的新通路。
更重要的是,该研究确定了一种癌症免疫治疗新策略——阻断PD-L2和RGMb之间的相互作用,可以增强对癌症免疫治疗的反应,并优化免疫细胞监测和杀伤癌细胞的能力,有助于治疗对PD-1-PD-L1阻断疗法无反应的癌症患者。

该论文的通讯作者、哈佛大学 Arlene Sharpe 教授表示,PD-L2和RGMb之间的结合起到了抗癌T细胞的刹车作用,这项研究表明,使用抗体阻断PD-L2与RGMb之间的相互作用的,可以释放这种刹车作用,帮助T细胞清除肿瘤。
论文里第一作者 Joon Seok Park 博士表示,这项研究为一个复杂的谜题提供了关键线索,并在此过程中提出了增强癌症免疫治疗效果和改善患者预后的具体方法——通过学习肠道细菌来帮助我们的免疫系统对抗癌症,从而克服对当前癌症免疫疗法的耐药性。
癌细胞的存活和扩散的关键是其逃逸人体免疫防御的能力,从20世纪90年代开始,Gordon Freeman 教授和 Arlene Sharpe 教授进行了一系列关键工作,阐明了癌细胞如何设法逃逸免疫系统。他们的研究重点是PD-L1和PD-L2,它们位于肿瘤表面,当PD-L1或PD-L2与T细胞表面的PD-1结合时,T细胞的肿瘤杀伤活性会受到抑制。他们二人未获2018年诺贝尔生理学或医学奖,也受到了广泛争议。

Arlene Sharpe 教授(左)和 Gordon Freeman 教授(右)夫妇
在正常情况下,PD-L1、PD-L2与PD-1之间的相互作用对T细胞起到了刹车作用,以确保它们不会错误地攻击人体自身的细胞和组织。而癌细胞学会了利用这一机制来逃逸T细胞的检查和杀伤作用。在这一发现的基础上,免疫检查点阻断疗法横空出世,通过阻断PD-1与PD-L1或PD-L2的相互作用,重新释放T细胞对癌细胞的攻击,这彻底改变了癌症治疗格局。
虽然以PD-1抑制剂为代表的免疫检查点阻断疗法已被用于治疗超过25种癌症类型,但仍有相当比例的癌症患者并没有从中获益。因此,调节PD-1抑制剂反应性的因素,以制定使更多癌症患者受益的策略,是非常有意义的。

Dennis Kasper 教授
多年来,免疫系统和肠道微生物群之间的相互作用一直是肠道菌群研究先驱 Dennis Kasper 教授的工作重点,他的实验室不仅确定了肠道微生物群与免疫系统之间的调节机制,还确定了负责调节免疫系统的特定微生物分子和微生物酶。
实际上,肠道微生物可能影响癌症免疫疗法的概念并不新鲜。最近的一些研究发现了肠道微生物在免疫治疗结果中所起作用的诱人线索,并表明肠道微生物群是免疫检查点抑制剂治疗期间抗肿瘤免疫的关键调节因子。肠道微生物群可以调节PD-1抑制剂在癌症中的功效。这些发现刺激了对益生菌和粪便移植的研究,以促进PD-1免疫治疗的抗肿瘤反应。
然而,到目前为止,科学家们还没有确切地了解肠道微生物群是如何影响癌症免疫治疗效果的。在这项最新研究中,研究团队希望能确定肠道微生物群调节癌症免疫治疗抗肿瘤效果的可靶向的免疫机制。
研究团队向小鼠结肠中植入了来自癌症患者的肠道微生物群,这些癌症患者中既有对免疫疗法反应良好的患者,也有对免疫疗法反应不佳的患者。这些人类肠道微生物群定植后,小鼠表现出了与对应人类患者类似的对免疫疗法的反应。
通过比较两组小鼠的免疫系统特征,研究团队发现了参与癌症监测和杀伤的各种免疫细胞存在明显差异。研究结果表明,肠道微生物群改变了免疫细胞的行为,从而改变了对免疫疗法的反应。
植入来自对癌症免疫疗法反应良好的人类患者的肠道微生物群的小鼠,其抗原呈递细胞(APC)上的PD-L2水平较低。这些免疫细胞通过在体内巡逻寻找病原体或肿瘤细胞,并将这些外来或异常蛋白质呈递给T细胞,在免疫防御中发挥着关键作用。相反,植入对癌症免疫疗法反应较差的人类患者的肠道微生物群的小鼠则PD-L2水平较高。
为了梳理出特定肠道微生物的影响,研究团队用广谱抗生素治疗了一组小鼠,这种抗生素可以杀死其肠道细菌。抗生素治疗后的小鼠对PD-1免疫疗法没有反应,然而,这些小鼠具有高水平的PD-L2,对同样的治疗有强烈反应的小鼠PD-L2水平较低。
研究团队推测,PD-L2不是单独通过PD-1来抑制T细胞,它可能还有其他帮凶,研究团队将注意力转向了RGMb,因为此前 Gordon Freeman 教授团队发现了RGMb和PD-L2调节肺部免疫耐受。
当研究团队使用阻断RGMb的抗体来治疗对抗PD-1治疗没有反应的小鼠时,这些小鼠的抗癌T细胞数量快速增加,且治疗效果得到显著改善。
Gordon Freeman 教授表示,在抗癌反应中,肠道微生物群和免疫细胞之间的相互作用开始变得更加清晰,随着RGMb作为PD-L2的分子帮凶的鉴定,我们有了癌症免疫治疗的一个新目标。在无菌小鼠中,需要RGMb或PD-L2阻断来增强PD-1阻断的作用,这表明PD-L2的抑制作用可能主要是通过RGMb-PD-L2相互作用,而不是PD-1-PD-L2相互作用。
进一步分析表明,RGMb与PD-L2之间的相互作用取决于肠道微生物的组成,某些肠道微生物可以影响这两种分子的水平。在患有癌症的小鼠的肠道中植入一种肠道细菌——C. cateniformis,能够抑制PD-L2水平,并使免疫疗法对癌症小鼠更有效。当然,研究团队表示,人类肠道中存在数千种不同的细菌,该细菌可能不是唯一能够调节抗肿瘤免疫反应的肠道微生物。研究团队还指出,可以进一步开发针对特定肠道微生物的小分子药物,以增强癌症免疫疗法的效果。
同样,将来自对癌症免疫疗法反应较差的人类患者的肠道微生物群植入小鼠肠道后,小鼠T细胞也有了较高水平的RGMb,这一发现表明,对癌症免疫治疗反应不佳的患者的T细胞上含有较高水平的RGMb,这反过来又干扰了免疫细胞的抗肿瘤反应。
抑制PD-L2或RGMb,足以保持T细胞的抗肿瘤活性,并确保对PD-L1或PD-1治疗的强劲反应。值得注意的是,阻断PD-L2,在接受另一种癌症免疫疗法——树突状细胞疗法的小鼠中也产生了更强的抗肿瘤反应。这一结果表明,调节PD-L2活性有望提高人体对多种癌症免疫疗法的反应。
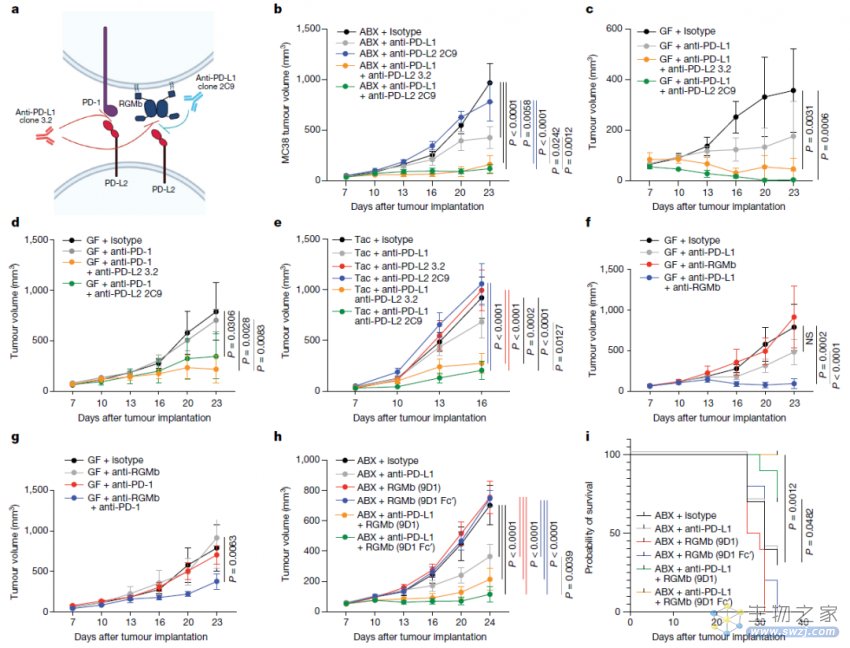
阻断PD-L2-RGMb,足以促进对单独抗PD-1或抗PD-L1治疗无反应的小鼠的抗肿瘤反应
总的来说,该研究表明,阻断PD-L2与RGMb之间的相互作用,联合抗PD-1或抗PD-L1疗法,可以克服肠道微生物依赖的PD-1抑制剂单一治疗的耐药性,并为治疗对PD-1癌症免疫治疗无反应的患者提供一种新策略。这项研究也提供了一种创新方法,利用肠道微生物作为发现平台来识别新的癌症免疫治疗靶点。
论文链接:https://www.nature.com/articles/s41586-023-06026-3































