细胞不仅有分裂还有分化,比如婴儿期胚胎干细胞可以分化为不同的体细胞,形成各种器官和组织。干细胞包括胚胎干细胞、成体干细胞和骨髓干细胞都有高浓度的端粒酶,这样才能反复分裂并形成组织器官。
来自明尼苏达大学微生物学和免疫学系免疫学中心的研究人员设计了一个模型,可以更好地了解记忆细胞分化,衰竭,癌症和衰老,并表明功能正常的T细胞可以保留非凡的种群扩张和寿命的潜力,远远超过其有机体寿命。相关研究成果近日发表在《Nature》杂志上。

https://www.nature.com/articles/s41586-022-05626-9#Sec6
01
“海弗里克极限”
1961年,莱奥纳德·海弗里克(Leonard Hayflick)发现,他动物胚胎细胞在成长过程中,其分裂的次数是有规律的,到一定阶段就出现衰老和死亡,这与细胞分裂的次数和周期有关,二者相乘即为其自然寿命。他把它叫作内部生物时钟。人们把这个时钟称为“海弗里克极限”,细胞分裂次数与端粒DNA长度有关。DNA复制一次端粒DNA就缩短一段,当缩短到Hayflick点时,细胞停止复制,走向衰亡。端粒的长度与端聚酶的活性有关,端聚酶是一种反转录酶,正常体细胞中缺乏此酶。
体细胞哺乳动物细胞的增殖程度一直存在争议。归因于端粒缩短,提出减少癌症但施加寿命限制,物种特异性体外细胞分裂限制与寿命相关(小鼠细胞经历更少的分裂,龟细胞经历更多)。物种特异性寿命限制可能是其他基本生物过程所固有的,包括复制依赖性DNA突变。例如,小鼠在其3年的寿命中积累的每个细胞的DNA突变数量与人类在其80年的寿命中相似,这也许揭示了一个保守的寿命定义边界。细胞寿命或增殖潜力的其他障碍包括蛋白质平衡和代谢适应性的丧失。
02
体外培养抗癌T细胞
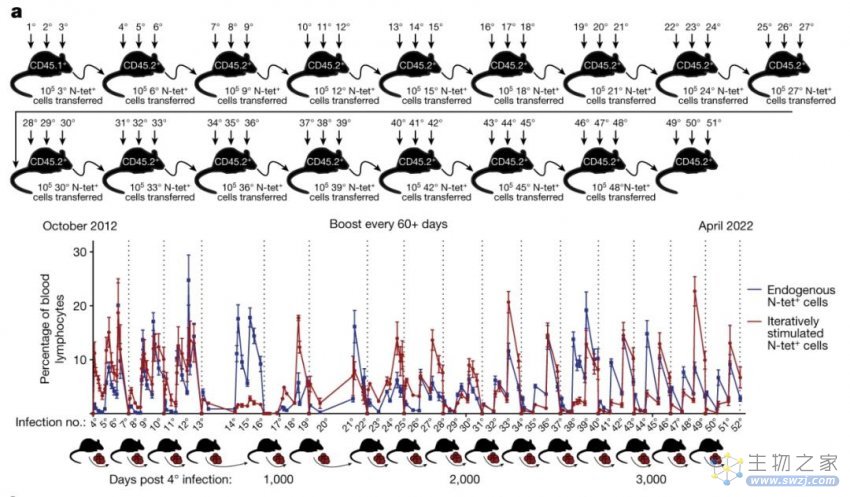
CD8 T淋巴细胞可以维持静止多年,但在激活后几分钟内参与分化程序,随后积累异常数量的快速细胞分裂。原代活化细胞经历约15-20次细胞分裂的程序性爆发,每天至少进行3次细胞分裂+15.这导致大规模的克隆扩增,并且是表征适应性免疫的特异性和记忆的基础。累积的T细胞分裂潜力本质上是有限的还是无限的,与慢性或复发性感染的控制,癌症、疫苗加强,年龄相关的免疫衰老和过继细胞疗法以及有关哺乳动物细胞生物学的基本问题有关。
自 1970 年代以来,有报道称 T 细胞偶尔可以在培养物中维持,尽管这是否是转型的结果一直存在争议,体外增殖限制与生物体生物学的相关性受到质疑。早期在体外培养抗癌T细胞的尝试导致了大量的种群,但它们在转移到患者身上时存活率很低。这归因于T细胞缺乏持久的“干性”,抗原经历的T细胞保留产生异质子细胞的能力被称为干细胞样,并在转移时提供更持久和可扩展的植入。“记忆干细胞”通常被描述为与幼稚T细胞(包括CD62L)共享标记物,尽管无限分裂电位的特性尚未经过测试。事实上,对慢性感染或癌症有反应的内源性T细胞会经历进行性体内“耗竭”,其定义是增殖能力受损,表达效应细胞因子的潜力丧失以及无法消除免疫靶标。
03
潜在生物学机制
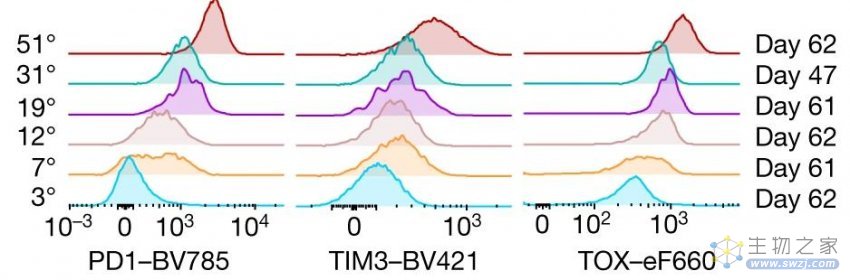
这些数据表明,T细胞本质上具有看似无限的种群扩张的能力,并且大大超过其宿主生物体。其他体细胞是否也表现出这种潜力尚不清楚。也许ISTCs可以帮助为生物学提供预防癌症的信息,以及保持细胞健康远远超出时间和经验的限制。
然而,ISTCs随时间和刺激历史在表观遗传,转录和表型上发生了变化。他们失去了与记忆T细胞“干性”相关的典型标记以及与 T 细胞衰竭和功能障碍相关的获得性标志物。
T细胞衰老,疲惫或死亡经常在慢性刺激,极端年龄和某些迭代刺激模型的情况下观察到。事实上,由于ISTC在每三次提升之前就被稀释了。ISTC提供了一个模型来剖析允许T细胞之间永久增殖能力和长寿的参数,以及维持健康的更广泛的潜在生物学机制。
参考资料:
https://www.nature.com/articles/s41586-022-05626-9#Sec6































