这是在这个被命运捉弄家族中的第二个例外——一位本该在中年时便出现阿尔茨海默病(AD)症状的男子,奇迹般地直到将近七十岁时才出现认知障碍的情形,比预期发病的时间晚了数十年。这个罕见的病例于今日发表于《自然》子刊Nature Medicine当中,而科学家对该病患的研究或许有望成为治疗阿尔茨海默病的新契机?
被命运捉弄的家族
这个现居于哥伦比亚的家族是世界上最大带有常染色体显性遗传性阿尔茨海默病(ADAD)的家族,他们的先祖源自三百年前来自欧洲西南部巴斯克(Basque)的一对夫妇。在约6000位存活的家庭成员中,有约1200位带有1型早老蛋白(PSEN1)E280A的突变。根据统计,这些ADAD患者在中位44岁(95% CI:43-45)时便会出现轻度认知障碍(MCI),并在中位49岁时(95% CI:49-50)产生痴呆的症状。

针对这个家族的研究发现,和携带野生型基因的个体相比,早在儿童时期,或者在临床症状发病中位年龄约三十年前,这些PSEN1 E280A突变携带者便出现大脑结构和功能异常,如皮层变薄和记忆网络中的超激活,以及体内阿尔茨海默病相关病理蛋白的差异。此外,这些带有PSEN1 E280A突变家族成员的脑部被发现生产过量的β淀粉样蛋白(Aβ),而淀粉样斑块正是阿尔茨海默病患者的典型标志。研究显示,PSEN1 E280A突变的外显度(penetrance)几乎是100%。也就是说,几乎所有的突变携带者都会产生阿尔茨海默病症状。
首个例外的“幸运儿”
然而在这看似无法改变的命运背后,总是有些上天眷顾的幸运儿。在2019年,Nature Medicine报告了来自这个哥伦比亚家族的一个特殊案例。一位携带PSEN1 E280A突变的家族成员,直到其七十多岁时才出现认知障碍的现象,与其他突变携带者相比,其发病时间足足晚了三十多年!

大脑影像分析发现,这位“幸运”女士的脑部与其他突变携带者一样,脑部神经细胞间存有大量淀粉样蛋白的累积,其脑部淀粉样蛋白斑块的含量甚至高于其他在四十多岁便发病的患者,并有些许神经退化特征。然而与其他人相比,她脑部神经细胞内的tau蛋白水平相对低下许多。tau蛋白的累积被认为会造成神经细胞的死亡。
在经过对此患者的基因组测序分析后发现,她两个APOE3基因的拷贝都带有一种被称为基督城突变(Christchurch mutation,R136S)的罕见序列。实验发现,带有基督城突变的APOE3蛋白与肝素硫酸蛋白聚糖(heparan sulphate proteoglycans)的结合能力不如野生型的APOE3。当这种糖分子与APOE结合时,能够使得tau蛋白在神经细胞之间传递并造成其死亡,因此这位患者所具的APOE3罕见突变可能是抑制患者大脑tau蛋白形成与神经细胞死亡,延缓其认知障碍发生的原因。过去的研究显示,不同形式的APOE蛋白一直与阿尔茨海默病有关:APOE4与APOE2分别增加与降低患病的风险,而APOE3在过往则被认为扮演中性角色(不存在APOE1)。
第二位“幸运儿”被发现
今天在Nature Medicine发表的案例是来自同样家族的第二位“幸运儿”,这位患者直到67岁时才出现认知障碍症状,在72岁时疾病进展为痴呆并在74岁时离世。与这个家族的首位“幸运儿”不同的是,这名病患的大脑同时存有大量淀粉样蛋白与tau蛋白的累积。不过与其他早期发病患者不同的是,在其脑部负责认知、学习,被称为内嗅皮层(entorhinal cortex)区域中的tau蛋白含量相对有限。

测序分析显示,这位患者并不携带APOE3基督城突变,而是带有络丝蛋白基因(RELN)新的罕见突变(H3447R)。RELN蛋白在发育中扮演重要角色,负责调控神经细胞的移动与神经突触的形成,并减缓神经细胞内tau蛋白的累积。实验发现,带有这个被研究人员命名为RELN-COLBOS突变的小鼠,其RELN蛋白的活性增加,最终造成tau蛋白磷酸化的下降以及在部分大脑区域tau蛋白累积的减少。
这项发现显示,“内嗅皮层的保存对于抵御阿尔茨海默病的极端保护是非常重要的。”马萨诸塞州总医院家族性痴呆神经影像实验室主任,也是这两篇论文作者之一的Yakeel Quiroz博士在写给行业媒体STAT的一封电子邮件中说道。
阿尔茨海默病缓解的新契机?
这两个案例的发现为开发缓解阿尔茨海默病疾病进展的疗法带来新的契机。研究团队认为若能开发出仿效这些突变蛋白效果的抗体或小分子,将有可能降低患者脑部tau蛋白的累积,进而延缓其认知障碍发生的时程。事实上,首位病例发现论文的第一作者,也是今天发布论文通讯作者之一的Joseph Arboleda-Velasquez博士,已共同创建了Epoch Biotech公司,打算开发基于基督城突变与RELN-COLBOS突变的疗法来治疗阿尔茨海默病患者。
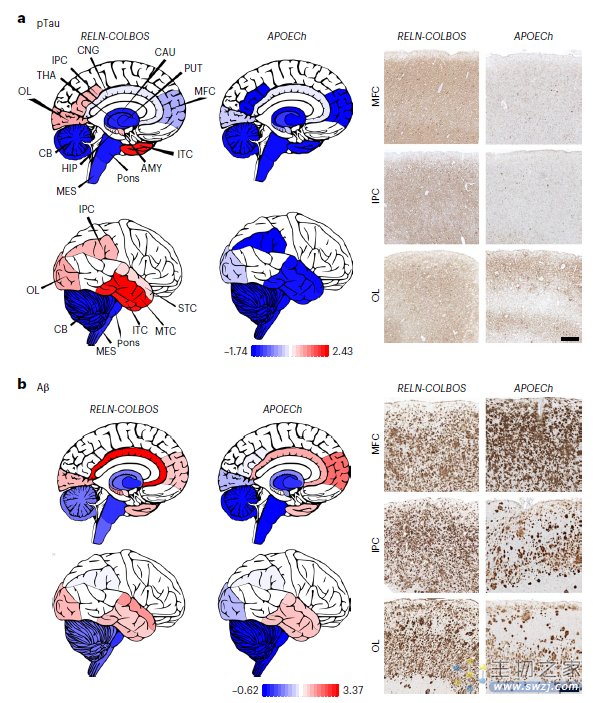
▲携带基督城突变(APOECh)与RELN-COLBOS突变患者大脑磷酸化tau蛋白与β淀粉样蛋白的分布(图片来源:参考资料[3])
然而值得注意的是,Arboleda-Velasquez博士也承认,除了这两个突变,病患体内可能还存有其他未发现的机制抑制其阿尔茨海默病症状的发生,并且需进行更多动物与人体试验才能确认这些突变的治疗潜力。其研究团队也在论文当中列出其他有可能造成疾病缓解的基因变异作为参考。在2022年举行的首届药明康德健康老龄化论坛中,UsAgainstAlzheimer's联合创始人兼主席George Vradenburg先生提到,如果不对大脑进行研究,健康老龄化的概念就毫无意义。这也是面对阿尔茨海默病全球性问题的关键。

▲George Vradenburg先生(图片来源:UsAgainstAlzheimer's官网)
让我们期待对这些“幸运儿”患者大脑的研究成果,会最终转化成临床应用的疗法,造福广大阿尔茨海默病患者及其家属。































