在人的一生中,机体基因组的改变会在体细胞中进行积累,然而,人类基因组中广泛存在的可移动元件—长散在核元件-1(L1,long interspersed nuclear element-1)的逆转录转座所诱导的突变蓝图在正常细胞中并不为研究人员所理解。

近日,一篇发表在国际杂志Nature上题为“Widespread somatic L1 retrotransposition in normal colorectal epithelium”的研究报告中,来自韩国科学技术院等机构的科学家们通过研究针对人类大肠的完整基因组中的跳跃基因进行了一项突破性的研究;文章中,研究人员揭示了长散在核元件-1(L1)非常令人惊讶的活性,这种类型的跳跃基因此前被认为在人类基因组中大多处于休眠状态,然而本文研究发现,L1基因则能被激活并在一个人的一生中破坏基因组的功能,尤其是在结直肠上皮组织中。
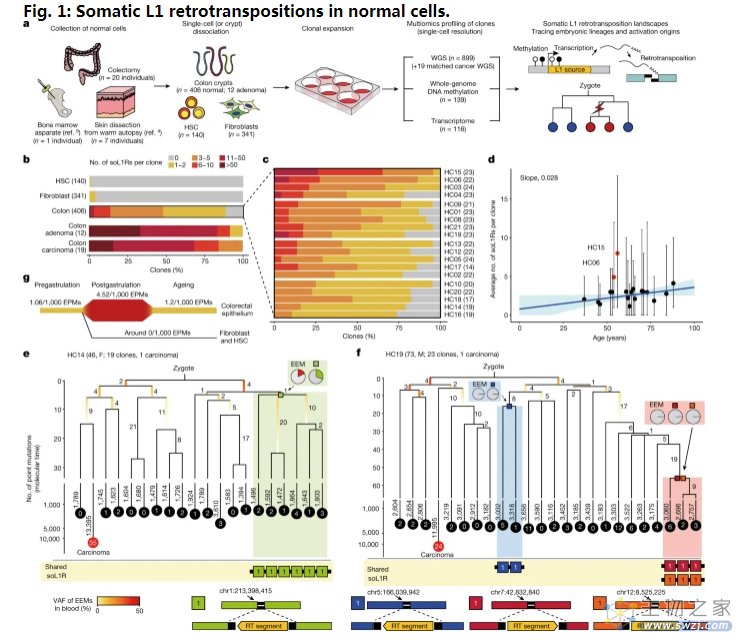
大约有50万个L1跳跃基因占据了人类基因组中17%的比例,其通常会因在基因组序列中引入“破坏性创新”(disruptive innovation)而在人类进化过程中所作出的贡献而为科学家们所知,截至目前为止,研究人员认为,大多数的L1元件在现代人类的正常组织中失去了跳跃的能力。然而,本文研究揭示,某些L1跳跃基因能在正常细胞中被广泛激活,从而导致个体在一生时间中基因组突变的积累,L1跳跃的速率和所导致的基因组变化在不同的细胞类型中有所不同,而且其在老化的结肠上皮细胞中会存在一个显著的浓度,本文研究表明,每个结肠上皮细胞都会在个体平均40岁时经历一次L1的跳跃事件。
“跳跃基因”或能改变人类结肠组织的基因组特征 从而有望揭示机体衰老和癌症发生的奥秘。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06046-z
文章中,研究人员对来自29名个体机体皮肤(成纤维细胞)、血液和结肠上皮组织中共899个单一细胞进行全基因组序列分析,结果发现了正常细胞中或许存在L1跳跃基因的激活,从而就会导致机体随着时间延续出现基因组突变的逐渐积累。此外,研究人员还深入探索了表观基因组(DNA甲基化)序列来理解L1跳跃基因激活背后的分子机制,他们发现,携带活性L1跳跃基因的细胞能表现出表观遗传的不稳定性,这也就表明了表观遗传学改变在调节L1跳跃基因活性上的关键角色;大多数的表观基因组不稳定性会出现在胚胎发育的早期阶段,相关研究结果货位人类结肠组织的老化过程和疾病的发展提供了非常宝贵的见解。
本文研究还阐明,正常细胞的基因组损伤不仅是通过暴露于致癌物而获得的,而且还会通过内源性组分的活性而获得,而这些成分所产生的影响此前研究人员并不清楚;研究者认为,表面上健康的衰老细胞的基因组(尤其是结直肠上皮组织)会因L1跳跃基因的活性而转变为嵌合体。Min Jung Kim教授说道,我们强调了临床医学和基础医学研究人员之间开展必要合作的重要性,本文中这一案例就强调了从临床环境中系统性地手机人类组织在解释人类疾病发生的复杂过程中的关键作用;我非常高兴研究人员在单细胞基因组技术上的进展取得了一定的成果,后期我们将会继续利用单细胞基因组技术进行更为深入的研究。
综上,本文研究结果阐明了L1逆转录转座在正常细胞中所诱导的体细胞嵌合现象,并深入理解了在人类一生中转录元件的基因组和表观基因组调节机制以及相关的意义。
原始出处:Nam, C.H., Youk, J., Kim, J.Y. et al. Widespread somatic L1 retrotransposition in normal colorectal epithelium. Nature 617, 540–547 (2023). doi:10.1038/s41586-023-06046-z































