
你是否曾经因为焦虑而感到心跳加速?这种心动过速是焦虑的主要症状之一,它是如此强烈,以至于经历过的人有时会误以为这是心脏病发作。
之前的实验研究揭示了许多将信号从大脑传递到心脏的通路,也就是情绪状态会影响身体功能,典型的例子就是焦虑和恐惧会令心跳加快。然而,在临床精神病学和基础神经科学领域,还有这一种截然相反的观点:心率升高也会引发焦虑或恐惧反应,但这个问题已经争论了长达一个世纪,仍然缺少直接实验证据。
这一问题之所以长期悬而未决,很大程度上是因为缺少一种适当的工具,能够在实现精确控制心率的同时,又不会引发副作用或引入干扰因素。
最近,这个百年争议终于得到了解决。
2023年3月1日,斯坦福大学的 Karl Deisseroth 教授团队在 Nature 发表了题为:Cardiogenic control of affective behavioural state 的研究论文。该研究确定了大脑检测心率的机制,并展示了这反过来是如何控制情绪行为的。
具体来说,Karl Deisseroth 教授团队开发了一种非侵入性的光学起搏器,能够在自由活动的小鼠中通过光信号精确靶向并控制其心肌细胞,无创提高小鼠心率,从而证实了心率升高与小鼠焦虑样行为的增加相关。这表明来自身体的信号可以通过某种方式影响与焦虑、恐惧等情绪相关的情感行为。

2005年8月,Karl Deisseroth 教授在 Nature Neuroscience 杂志发表了一篇具有里程碑意义的研究论文,这项研究发现,光敏感通道蛋白ChR2可以在哺乳动物神经元中稳定且安全表达,在被光脉冲激活时,ChR2可以以毫秒级时间分辨率控制兴奋性或抑制性突触传递。这项研究为神经科学提供了革命性的研究手段,标志着光遗传学(Optogenetics)的正式到来,Karl Deisseroth 教授也因此被被称为“光遗传学之父”。
值得一提的是,当时年仅23岁的张锋是这篇里程碑论文的第二作者,8年后,张锋因首次将CRISPR-Cas9基因编辑技术成功应用于哺乳动物和人类细胞而轰动科学界。

在这项最新研究中,Karl Deisseroth 教授团队开发了一种非侵入性的光学起搏器,该起搏器调控心率与关遗传学调控神经元类似。
具体来说,他们使用AAV9型(该血清型能够特异性靶向心脏组织)来递送表达光敏感通道蛋白ChRmine的基因。通过眼眶后注射,AA9可使ChRmine在小鼠整个心脏的心肌细胞中特异性且均匀表达(通过小鼠心肌肌钙蛋白T启动子启动),而在其他心脏细胞类型或其他器官中则无脱靶表达。这样就能够通过光信号来控制心肌细胞,触发心肌细胞收缩、加速心跳。
研究团队使用这一非侵入性的光学起搏器对小鼠进行实验,利用光信号靶向控制心肌细胞,可以将小鼠的心率提高到每分钟900次(其基准心率为每分钟660次),在光信号停止后,其心率会立即恢复正常。
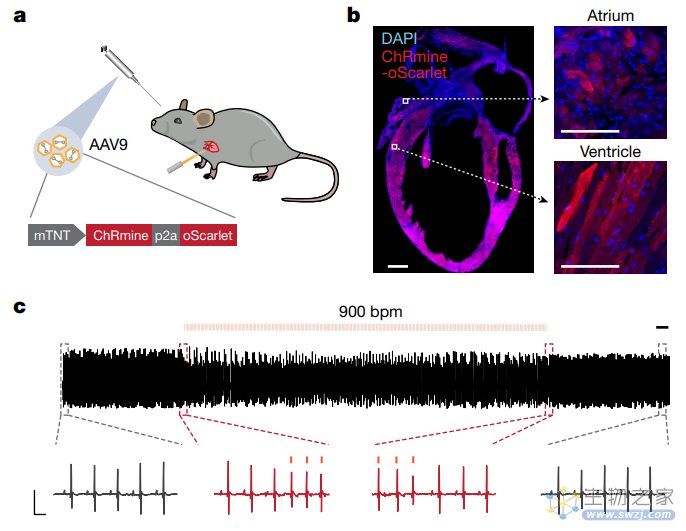
研究团队发现,光学诱导的心率升高增强了小鼠的焦虑样行为和恐惧,但这种现象仅出现在有潜在风险的环境中,这表明中枢(大脑)和外周(身体)过程都可能参与情绪状态的发展。
为了研究这种效应的潜在机制,研究团队扫描了小鼠大脑的活动变化。他们发现,后岛叶皮层(posterior insular cortex)这一大脑中负责接收和处理身体信号的区域或介导了心率升高诱发的焦虑样和恐惧行为。此外,他们还发现,对后岛叶皮层的抑制能减少由光学诱导的心率升高所诱发的焦虑样行为。
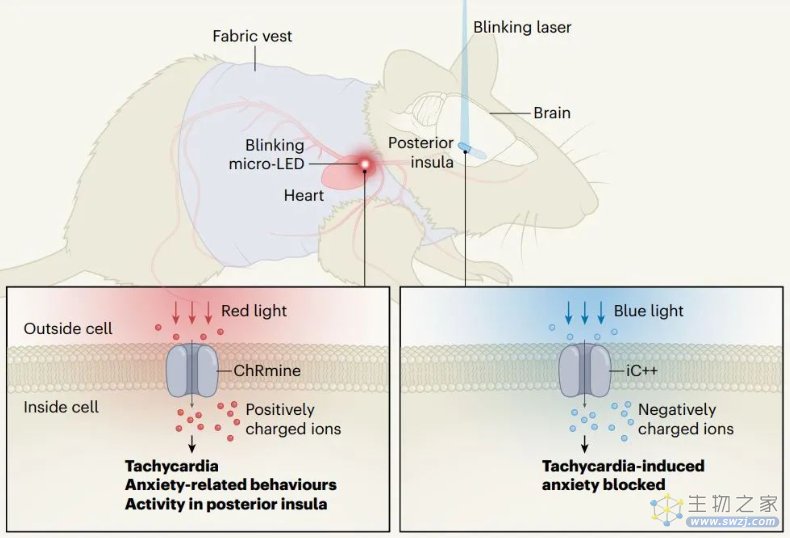
Nature 期刊同期配发了法国波尔多大学 Anna Beyeler 教授撰写的新闻与观点文章,她表示,这是一个明确的证明,至少在小鼠中,心率会影响焦虑,并且可能也会影响其他情绪行为。

总的来说,这项研究表明,必须对中枢(大脑)和外周(身体)的细胞通盘考虑,才能理解情绪或情感状态的起源。更重要的是,这项研究表明,在完全完整的、可自由行动的哺乳动物中,进行细胞类型特异性的、时间精确的、非侵入性的器官尺度生理学扰动是可实现的。而且这一方法不需要专门的光电子学或手术,有可能广泛应用于整个身体的一系列生理系统,为探索健康、疾病和治疗中生理系统之间的复杂相互作用提供了无数机会,具有巨大的潜在转化和治疗应用价值。
论文链接:
https://www.nature.com/articles/nn1525
https://www.nature.com/articles/s41586-023-05728-y
https://www.nature.com/articles/d41586-023-00502-6































