最近,哈佛医学院的研究者在《细胞》上发表了一篇重磅论文,研究找到了个体衰老的关键影响因素。我们过去可能认为DNA的变化是衰老产生的最主要原因,然而新研究几乎推翻了这一推测,根据他们的数据,DNA变化不但不是唯一,甚至不是主要的衰老原因。

真正起作用的是那些影响DNA结构、调控DNA表达的分子,也就是常说的表观遗传分子。一旦表观遗传退化,衰老才会真正地来临。
按照过去的推测,随着个体年龄的增长,DNA更容易累积基因突变等导致的错误变化,这些变化会影响基因活性,最后使细胞、组织功能失常,这也是衰老的重要体现。
但是一些研究发现故事并非如此简单,比如有些小鼠和人类患者拥有高于平均的突变水平,但是这些个体并没有表现出早衰的迹象。这些结果表明基因变化的作用有限,于是David Sinclair教授团队开始将表观遗传纳入考虑范畴。
表观遗传分子可以充当基因活性的开关,它们可以通过影响染色体结构决定基因的表达活性。早在20年前,Sinclair教授就在酵母菌中发现表观遗传变化与衰老是同步的。

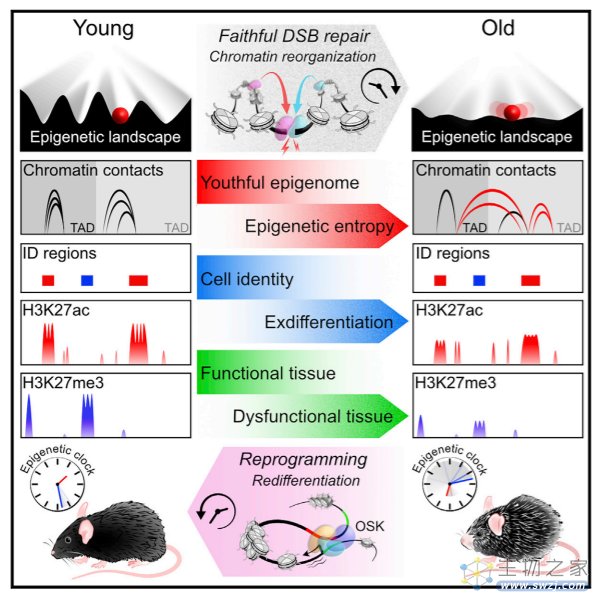
在最新的论文中,他们将研究对象扩展到了小鼠身上,研究者给小鼠的DNA引入一些暂时性且能快速修复的切口,这些细微的损伤可以模拟我们日常所遇到的情况,比如紫外线、化学分子和自由基损伤等。
为了更好地追踪衰老变化,研究者增加了DNA切口引入的频率,并且这些切口不会出现在DNA编码区,因此不会造成蛋白改变,但切口会改变DNA折叠。
根据观察,表观遗传分子会暂时停止调控基因的工作,转头迁移到切口附近帮助完成DNA修复,随后会返回到原始的位置继续本职工作。
这种情况一次两次还好,随着时间推移,DNA切口出现的情况变多,表观遗传分子开始逐渐分心,它们去往切口完成修复工作后不再返回原来的位置。这意味着,表观遗传变得失去组织,原本需要调节的DNA也处于失控状态。
研究者指出这是典型的表观遗传失调,长此以往,染色体会变得更致密,难以解开。
▲研究示意图(图片来源:参考资料[1])
这种基因层面的异常会使得小鼠失去原本年轻时的表观遗传功能,直观的表现就是小鼠看起来比同龄正常小鼠更老,行动也更像老年小鼠。除此之外,研究者可以在实验小鼠中检测到逐渐升高的衰老标志物,与此对应的,它们的生物学年龄也比同龄健康小鼠更大。
从时间上来看,这些实验小鼠仅在6个月大的时候就会出现衰老迹象,而正常小鼠会在约两岁时才出现。
当然,Sinclair教授指出这种表观遗传失调引起的衰老并非不可逆,他们独创了一种基因疗法,其中包括3种干细胞活跃的基因Oct4、Sox2 和 Klf4。这种基因疗法可以帮助实验小鼠的细胞恢复到年轻的状态,它们似乎可以让表观遗传失调的细胞重新启动。
这也为恢复细胞活力,控制衰老提供了新的思路。Sinclair教授指出,他们的目标是解决衰老以及衰老附带的疾病,一个人不仅可以活着,还可以保持健康,这才是最终的应用目的。
参考资料:
[1] Jae-Hyun Yang et al, Loss of epigenetic information as a cause of mammalian aging, Cell (2023). DOI: 10.1016/j.cell.2022.12.027
[2] Loss of epigenetic information can drive aging, restoration can reverse it. Retrieved January 13, 2023 from https://medicalxpress.com/news/2023-01-loss-epigenetic-aging-reverse.html































