研究显示:相较于女性,男性患自身免疫病的概率较低,但在被病毒感染后,男性的抗病毒免疫反应比女性更弱[1]。
自然杀伤(NK)细胞是先天免疫的效应细胞,它们具有发现并且迅速杀死受到感染、癌变、外来或应激细胞的能力[2]。作为抗癌「特种兵」,NK 细胞近年来受到广泛关注。
最新研究表明,NK 细胞在性别上也存在着明显的差异[1]。结果显示,雄性小鼠的 NK 细胞数目多于雌性,但功能较弱,由于转录调控因子 Kdm6a(编码蛋白 UTX)逃脱 X 染色体后失活,使其表达水平在雄性 NK 细胞中低于雌性,UTX 通过重塑染色质调控基因表达,抑制 NK 细胞内稳态,但促进其效应功能[1]。
据大量研究结果表明,NK 细胞在抗肿瘤治疗领域举足轻重,既可以直接杀死肿瘤细胞,又可以迅速表达多种细胞因子和趋化因子,募集其它免疫细胞和促进 T 细胞和 B 细胞的适应性免疫反应。因此,NK 细胞已成为免疫疗法的理想靶标,其典型效应功能之一是通过 CD16 受体介导的 ADCC,杀死 IgG1 或 IgG3 抗体靶向的细胞。
ClinicalTrials.gov 网站显示,NK 及 CAR-T 相关研究正如火如荼地进行,已经占据免疫细胞疗法的 60%,能够有效弥补男女患者体内 NK 细胞数量不同的劣势。CAR-T 细胞疗法是第一个进入临床转化和商业化的疗法。然而,CAR-T 要求患者以自体细胞为原材料并延长了「静脉到静脉的时间」,因此对于疾病快速进展、迫切需要治疗的患者来说是一个巨大的障碍。
此外,在临床上,CAR-T 引起的细胞因子释放综合征(cytokine release syndrome,CRS)和神经毒性更是不可忽视的问题。鉴于这些限制,科学家们将目光放在了能克服 CAR-T 疗法局限性的 CAR-NK 细胞上面。
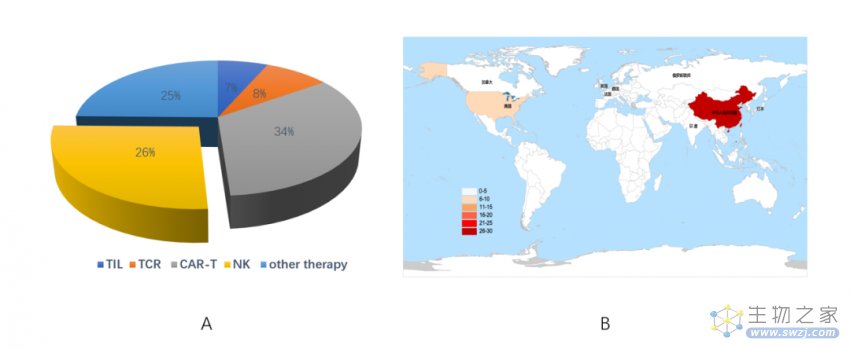
图 1. 免疫细胞疗法及 CAR-NK 相关临床实验统计图
A. 截止 2022 年 11 月 11 日,ClinicalTrials.gov 网站上显示与免疫细胞疗法相关的研究 B. CAR-NK 相关临床实验全球分布统计图
极具前途的 CAR-NK 细胞疗法
CAR-NK 细胞疗法越来越多地被用于评估和治疗多种恶性肿瘤,NK 细胞具有显著的肿瘤清除和招募其他免疫亚群的能力,且无需像 T 细胞或 B 细胞那样预先呈递抗原。循环中 CAR-NK 细胞的寿命有限,靶向非肿瘤或正常组织的风险相对较低。同种异体 CAR-NK 细胞输注可降低移植物抗宿主病(graft versus host disease,GVHD)的风险,CRS 和神经毒性也极少发生。
由于这些潜在的优势,脐带血、外周血细胞、NK-92 细胞系和诱导多能干细胞(induced pluripotent stem cells,iPSCs)来源的 NK 细胞均极具临床价值,以便用于 CAR 工程。由 iPSC 产生的 NK 细胞已成为一种极具潜力的策略,可以生产具有抗肿瘤活性的标准化现货型 NK 细胞。
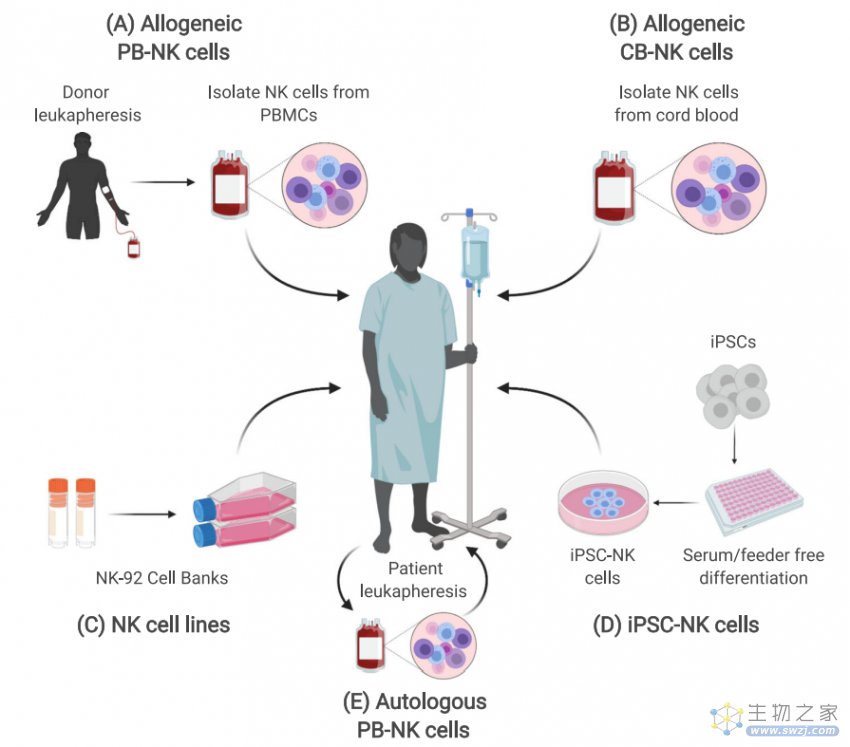
图 2. CAR-NK 细胞的来源[1]
iPSC :「现货」NK 细胞供应商
目前大多数 CAR-NK 细胞的临床试验都使用 NK-92 细胞系,因其在体外具有无限的增殖能力、对重复冻融的敏感性较低的特点,并能根据 GMP 规范扩增大量临床用细胞。这些特性在制造临床的「现货」CAR-NK 产品时,占据了明显的优势。然而,NK-92 细胞作为肿瘤细胞系具有潜在的致瘤性风险,且输注前的辐照会导致体内扩增潜力丧失。iPSC-NK 不仅为CAR-NK 细胞治疗提供了另一种途径, 而且它为「现货」的 CAR-NK 细胞产品提供了可再生资源。
此外,来源于血液的具有自然异质性,使得过继转移前 NK 细胞功能和扩增潜力的验证更加复杂。与 PB-NK 或 UB-NK 相比,iPSC-NK 细胞具有克隆生长、高扩增及体外分化的能力,能生产出大量均质 NK 细胞。iPSC-NK 细胞结合了原代 NK 细胞和 NK-92 细胞系最具吸引力的优势,即高细胞毒性且冷冻保存后也能在体内持续扩增。
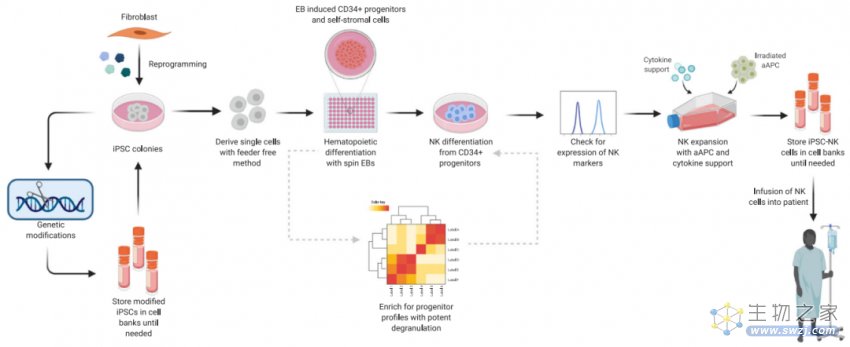
图 3. iPSC-NK 细胞疗法制造示意图[1]
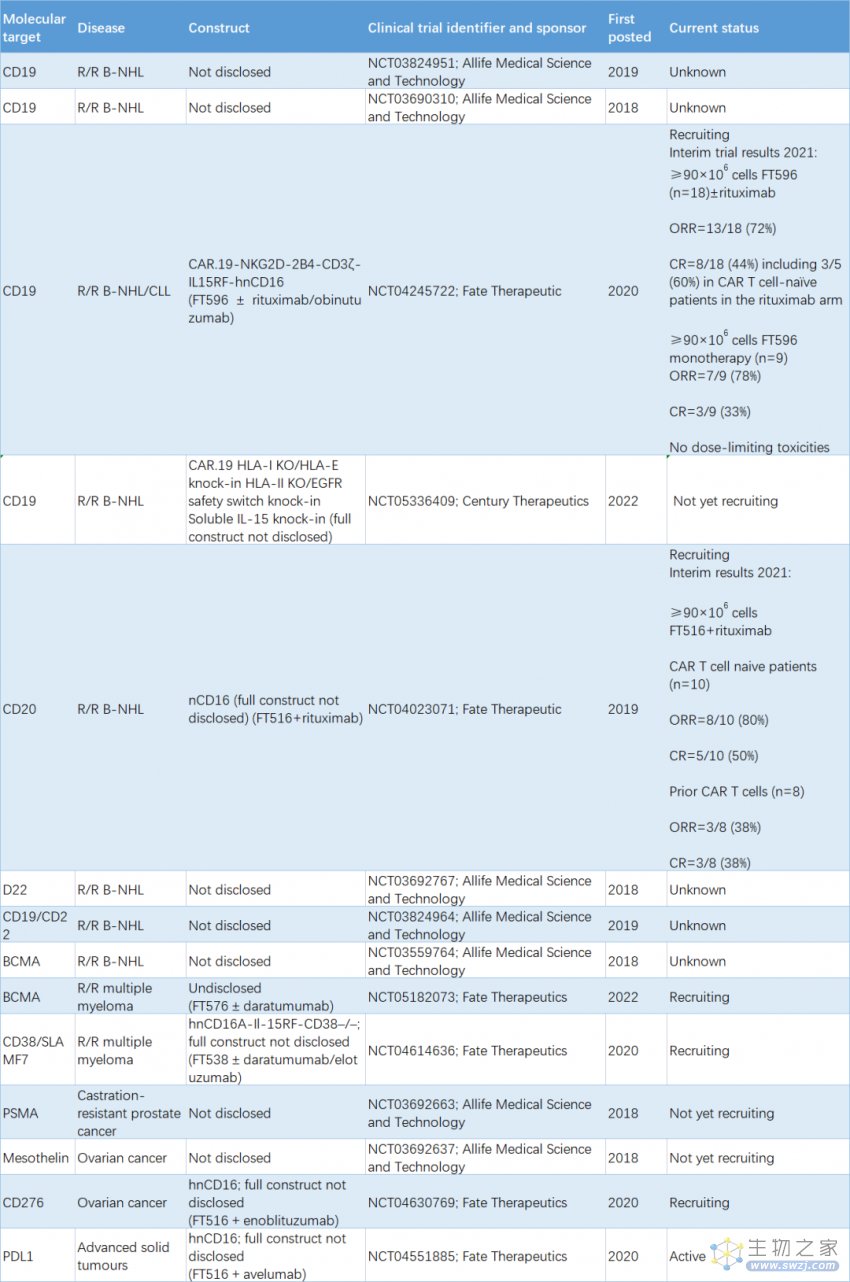
尽管 iPSC-NK 还没有获得 FDA 批准临床转化的疗法,但临床研究的数量逐年增加。一些正在进行的临床实验显示,iPSC-NK 细胞疗法具有强烈的抗肿瘤反应。例如,iPSC-NK 细胞在体外对多种血液和实体瘤细胞系(包括卵巢癌、髓系白血病和黑色素瘤)表现出效应细胞毒性反应(表 1)。
表 1. 研究 iPSC-NK 细胞治疗产品的临床研究[2, 3]
iPSC-NK 的发展蓝图
在原代 NK 细胞中,涉及许多细胞死亡的病毒整合是一个效率低下的工程。然而,iPSC 细胞非常适合这些病毒整合方法,允许直接敲入或敲除基因,iPSC-NK 细胞更容易以可靠和有效的方式进行基因工程改造。iPSC-NK 细胞经过基因工程改造,可克服与 NK 疗法相关的各种限制。
可尝试的 iPSC-NK 修饰包括:1)CD16 受体的突变版本以抑制 ADAM17 蛋白酶的切割,从而增强 ADCC 和抗肿瘤能力;2)IL15/IL15r 融合受体以改善体内持久性;3)CARs 用于改善抗肿瘤细胞毒性;4)CD38 受体敲除以防止组合抗体治疗的相互干扰;5)重组 CD4/CD3 ζ受体增加 NK 细胞毒性;6)删除 CISH 基因来靶向检查点抑制剂。iPSC 经过基因修饰大大提高了抗肿瘤活性及持久性。寻找一种方法使 CAR-NK 细胞更安全有效,这对于下一代细胞疗法至关重要。iPSC-CAR-NK 技术可能是未来更加优于 CAR-T 的免疫细胞疗法。
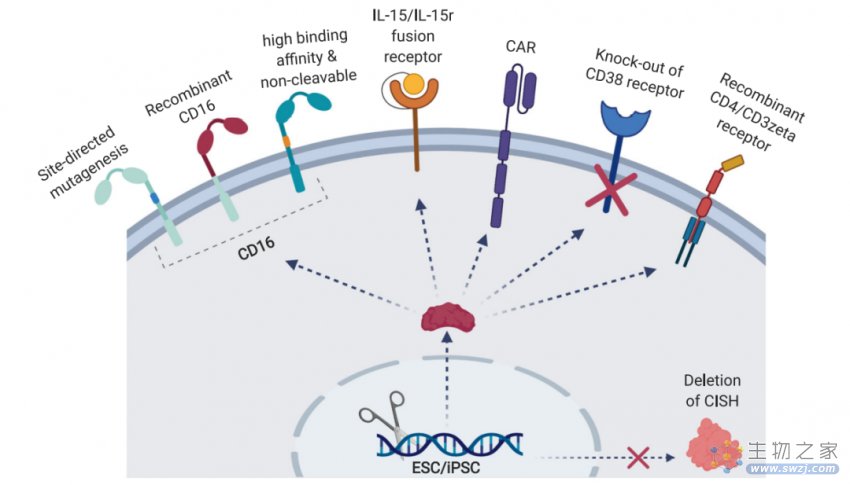
图 4. 基因修饰 iPSC-NK 疗法[3]
看过文章的小伙伴们,有没有对 iPSC-NK 细胞疗法产生浓厚的兴趣?Bio-Techne 能为您提供 iPSC-NK 细胞研究完整的解决方案。
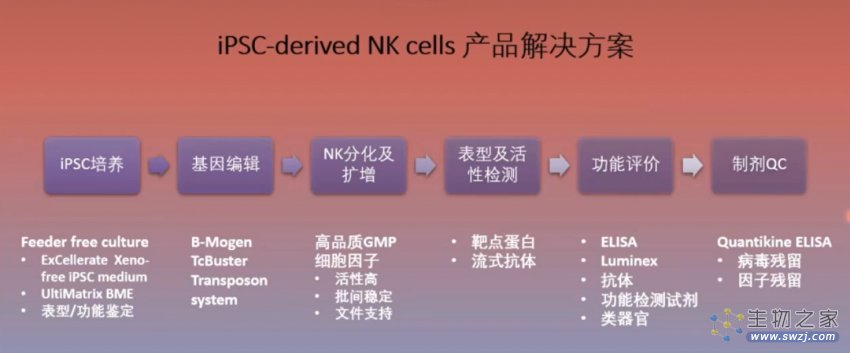
图 5. iPSC-NK 细胞产品解决方案
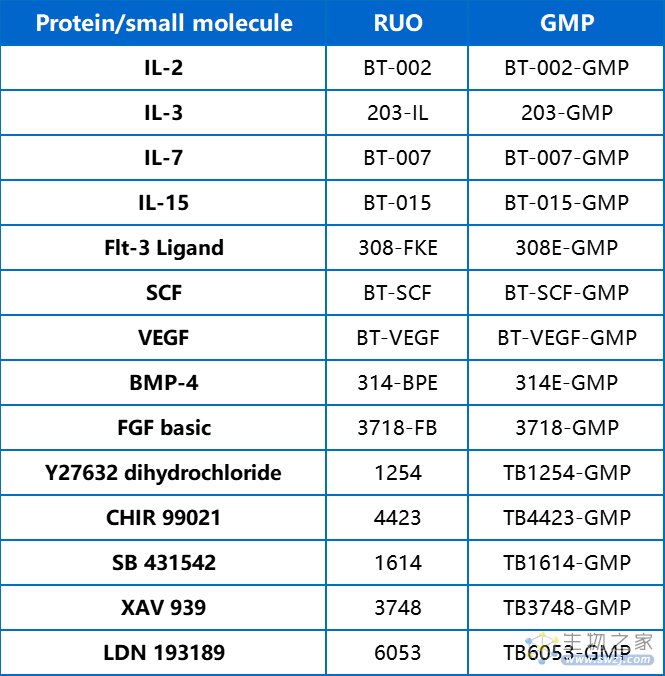
iPSC 诱导分化常用蛋白或小分子:
参考文献
[1] Cheng MI, Li JH, Riggan L, et al. The X-linked epigenetic regulator UTX controls NK cell-intrinsic sex differences [published online ahead of print, 2023 Mar 16]. Nat Immunol. 2023;10.1038/s41590-023-01463-8. doi:10.1038/s41590-023-01463-8
[2] Maskalenko et al., (2022). Harnessing natural killer cells for cancer immunotherapy: dispatching the first responders. Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-022-00413-7
[3] Zhang L, Meng Y, Feng X, Han Z. CAR-NK cells for cancer immunotherapy: from bench to bedside. Biomark Res. 2022 Mar 18;10(1):12. doi: 10.1186/s40364-022-00364-6. PMID: 35303962; PMCID: PMC8932134.
[4] Laskowski TJ, Biederstädt A, Rezvani K. Natural killer cells in antitumour adoptive cell immunotherapy. Nat Rev Cancer. 2022 Oct;22(10):557-575. doi: 10.1038/s41568-022-00491-0. Epub 2022 Jul 25. PMID: 35879429; PMCID: PMC9309992.































