CRISPR基因编辑技术自问世以来,就表现出无可比拟的优势,并深刻改变了基因编辑领域乃至整个生命科学的研究模式。在原理上,以CRISPR-Cas9系统为例,Cas9蛋白在gRNA的引导下靶向与之互补的DNA双链并造成DNA双链断裂(DSB),从而在该基因位点造成插入或缺失突变。
值得注意的是,DNA双链断裂(DSB)后的细胞修复过程是难以控制和预料的,可能导致不必要的基因改变。如果能开发一种替代技术,可以在不产生DNA双链断裂的情况下改变基因,从而在保留CRISPR基因编辑技术优点的同时,还能提高其安全性和可操控性,这对科学研究和药物开发十分重要。
近日,美国哥伦比亚大学的研究人员在 Nature Biotechnology 期刊发表了题为:Targeted DNA integration in human cells without double-strand breaks using CRISPR-associated transposases 的研究论文。
该研究报告了一种通过使用I-F型CRISPR相关转座酶(CAST)来避免产生DNA双链断裂(DSB)并在人类细胞中实现大片段DNA定向整合的可编程集成方法,为利用CRISPR相关转座酶进行人类基因组工程奠定了坚实的基础。

CRISPR基因编辑技术因其易于编程性和高效活性而广泛应用于基础研究、农业应用和医学治疗。然而,该技术会引发DNA双链断裂(DSB),并依赖于非同源末端连接(NHEJ)和同源定向修复(HDR)进行修复。近期一些研究进一步强调了基于DNA双链断裂(DSB)的基因组编辑的不良事件,包括大规模基因组缺失、染色体易位和染色体碎裂等,这影响了基因编辑效果并可能造成严重的安全问题。
为了开发效率更高、安全性更好的基因编辑技术,最近的研究试图通过将Cas9融合到各种转座酶结构域以获得RNA引导的转座酶,但这些努力仍然依赖于DNA双链断裂(DSB)并且未能实现严格的特异性控制。相比之下,细菌的CRISPR相关转座酶(CAST)可以在不依赖DNA双链断裂(DSB)的情况下靶向插入大片段DNA序列。
基于此,研究团队最近报道了使用源自霍乱弧菌Tn6677的I-F型CRISPR相关转座酶(CAST)系统在多种细菌物种中实现不依赖DNA双链断裂(DSB)的DNA插入,并证明该方法表现出精细的全基因组特异性,可以轻松实现单碱基精度的基因编辑。
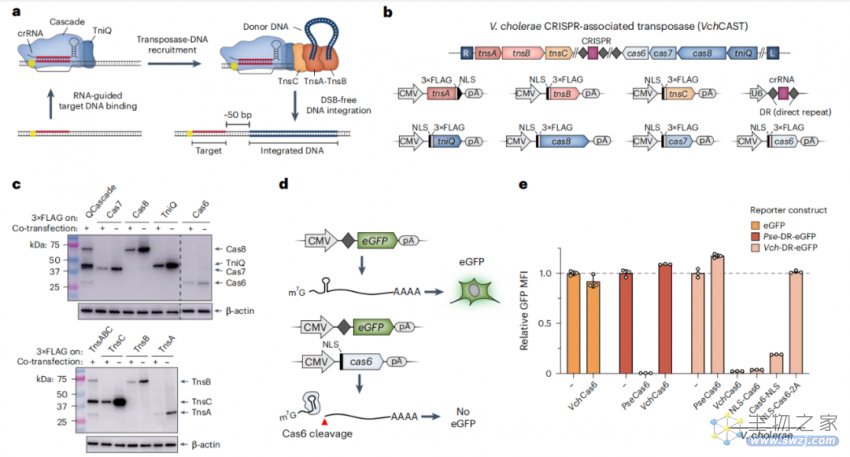
人类细胞中蛋白质-RNA CAST成分的重组
在这项最新研究中,研究团队试图利用RNA引导CAST系统在哺乳动物细胞中进行靶向DNA整合。研究人员验证了不同CAST系统在哺乳动物细胞中的活性,并证明RNA引导转位的决定因子在其他细菌和和真核生物中也同样适用。
研究团队通过蛋白质设计优化了QCascade复合物的DNA靶向,并开发了一种RNA引导的AAA+ ATP酶TnsC的多价募集策略,并以此实现了与传统的基于dCas9相似的有效转录激活水平。
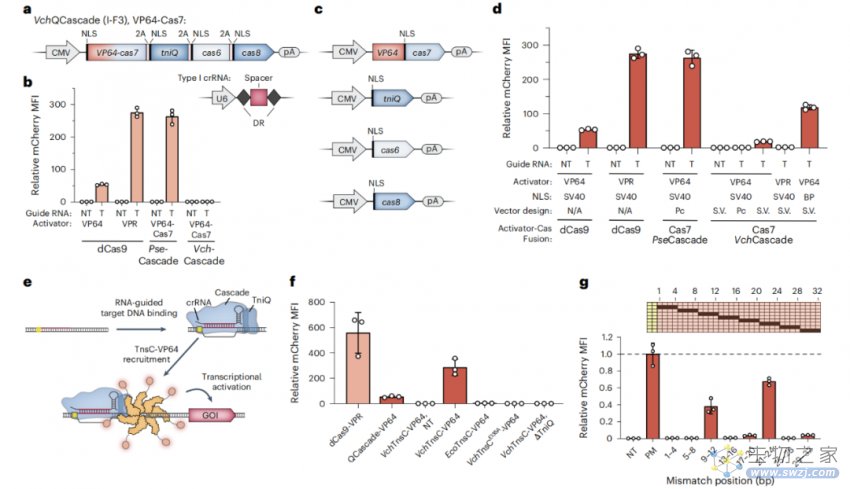
开发基于QCascade和基于TnsC的转录激活子来监测DNA靶向
在初步检测到基于质粒的整合后,研究团队从广泛的细菌宿主中筛选了15个CAST系统,从假交替单胞菌中鉴定出一个同源物,该同源物表现出更好的活性,并进一步提高了整合效率。
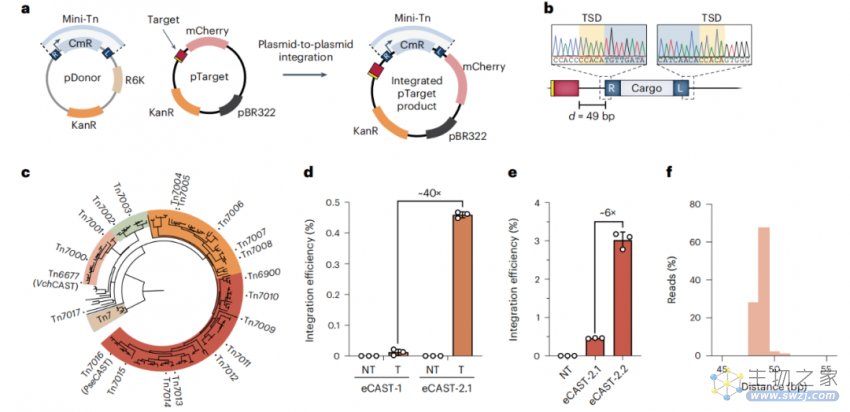
在游离型质粒中,基于RNA引导在人类细胞中使用不同的DNA整合
更重要的是,研究团队还发现,细菌ClpX是一个关键的辅助因子,它可以将基因组整合增强了两个数量级以上。这可能是ClpX通过促进整合后CAST复合体的主动分解,类似于它在Mu转位中的已知作用。
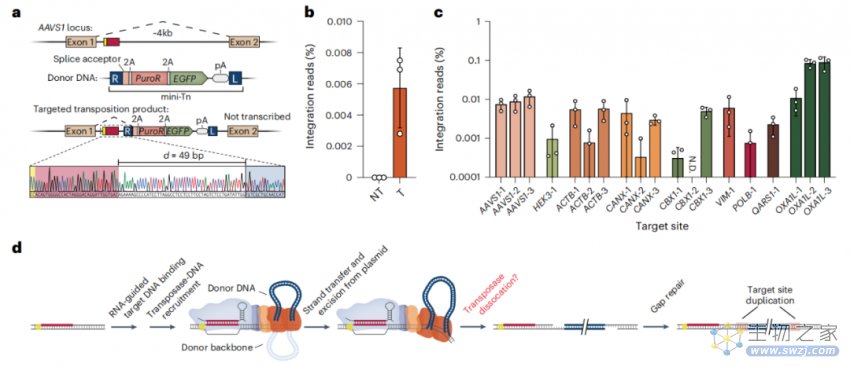
ClpX介导的用eCAST-3增强基因组DNA整合
总而言之,这项研究突出了多组分的CRISPR相关转座酶(CAST)系统在人类细胞中的基因组整合能力,挑战了目前基因编辑领域对单组分编辑因子(例如Cas9)的依赖,并为利用CRISPR相关转座酶(CAST)进行真核基因组工程奠定了坚实的基础。
论文链接:
https://www.nature.com/articles/s41587-023-01748-1































