肿瘤微环境中代谢重编程对抗肿瘤免疫有重要的调控作用。目前其潜在的机制尚不清楚,也鲜有报道以肿瘤代谢为靶点的治疗方法。
癌症的特点是连续的基因变化,导致不受控制生长和扩散到身体的其他部位。肿瘤中基因组的不稳定性会产生新抗原,这些新抗原可以被捕获、加工并呈递给CD8+T细胞,导致T细胞被激活、识别并靶向杀伤癌细胞。
ZAP70是一种蛋白酪氨酸激酶,在CD8+T细胞激活的启动事件中起关键作用。临床上,肿瘤浸润淋巴细胞(TIL)的存在已被证明与患者预后和生存率改善有关。然而,除了新抗原呈递缺失或对T细胞产生的细胞因子不敏感等内在因素外,肿瘤还可以通过免疫编辑肿瘤微环境(TME)来抑制T细胞浸润和活化或耗竭,从而获得免疫逃逸能力。因此,深入了解TME中的免疫编辑可能为抗肿瘤免疫提供新见解。
事实上,目前已经开发了许多用于癌症治疗的免疫疗法,包括免疫检查点阻断疗法(例如PD-1、PD-L1抑制剂)和工程细胞疗法(例如CAR-T、TCR-T细胞疗法)。然而,主要由于肿瘤微环境的抑制作用,这些免疫疗法往往免疫功能低下,而且所涉及的分子机制在很大程度上仍然未知。
2023年5月12日,清华大学生命科学学院江鹏课题组与武汉科技大学祝海川课题组和北京大学张新祥课题组合作,在 Cell Metabolism 期刊发表了题为:Cancer-cell-derived fumarate suppresses the anti-tumor capacity of CD8+ T cells in the tumor microenvironment 的研究论文。
该研究发现,肿瘤中延胡索酸水解酶(fumarate hydratase,FH)的特异型缺失抑制了CD8+T细胞的浸润,肿瘤微环境中的延胡索酸通过ZAP70信号抑制CD8+T细胞活化和抗肿瘤功能,而增加肿瘤微环境中延胡索酸的水解,能够显著增强CAR-T细胞抗肿瘤功效。

微环境中的代谢改变显著调节肿瘤免疫敏感性,但其潜在机制尚不清楚。在这项最新研究中,研究团队揭示了延胡索酸水解酶(fumarate hydratase,FH)缺失的肿瘤表现出抑制功能性CD8+T细胞的激活、扩增和疗效,并增强恶性增殖能力。
在机制上,肿瘤细胞中延胡索酸水解酶(FH)的耗竭使延胡索酸在肿瘤间质液中积累,延胡索酸的增加,可直接使酪氨酸激酶ZAP70在C96和C102处琥珀酸化,并使其浸润CD8+T细胞的活性丧失,从而抑制CD8+T细胞的活化和抗肿瘤免疫反应。
此外,该研究还发现,增加延胡索酸水解酶(FH)的表达能够减少延胡索酸水平,进而显著增强抗CD19 CAR-T细胞的抗肿瘤功效。
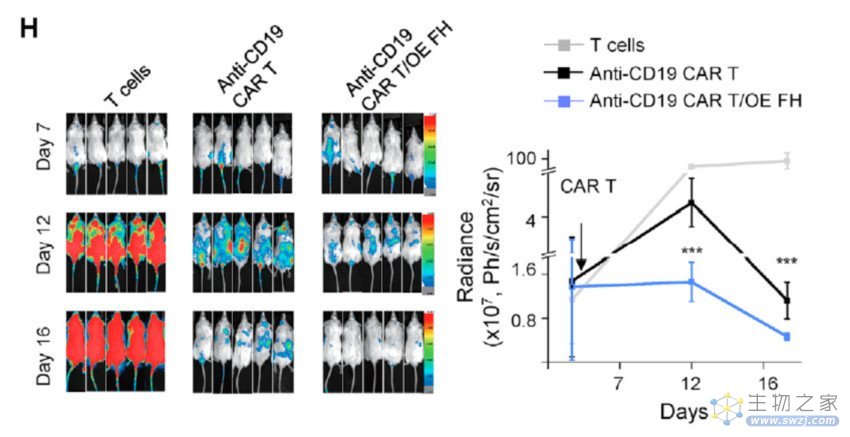
增加延胡索酸水解酶(FH)的表达,可显著增强抗CD19 CAR-T细胞的抗肿瘤功效
总的来说,这些发现证明了延胡索酸在调控TCR信号转导中的重要作用,并表明延胡索酸在肿瘤微环境(TME)中的积累是CD8+T细胞抗肿瘤功能的代谢屏障。进而提出了一种潜在的肿瘤免疫治疗新策略——增加肿瘤微环境中延胡索酸的水解,提高CAR-T等肿瘤免疫治疗效果。
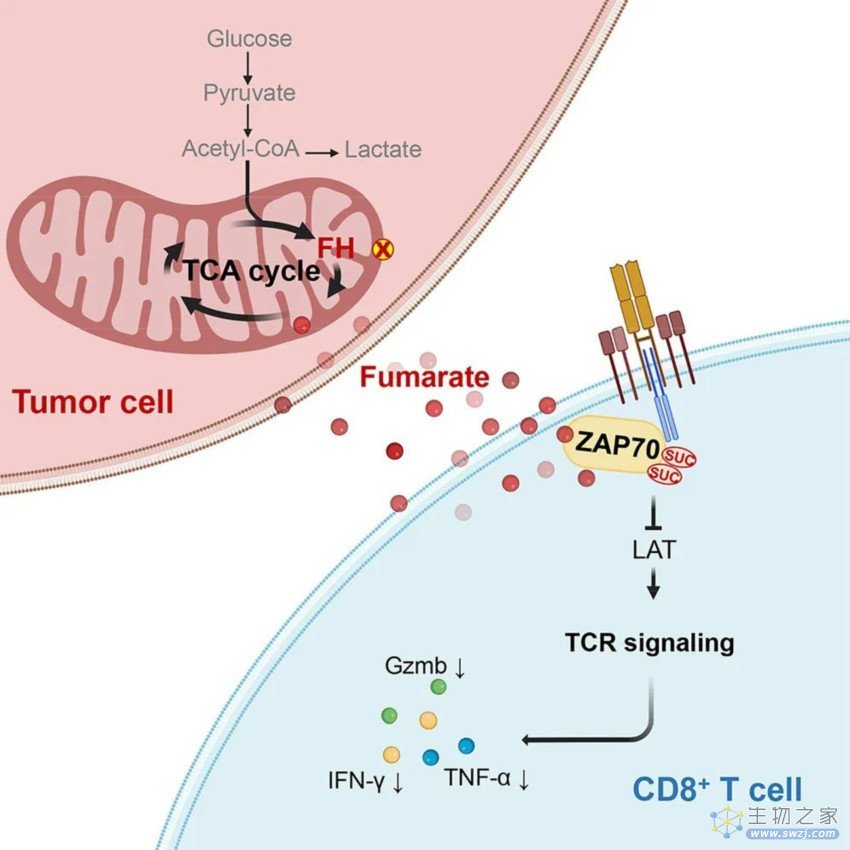
肿瘤细胞中延胡索酸水解酶(FH)的特异性确实导致延胡索酸积累,从而抑制ZAP70-TCR信号通路,进而抑制CD8+T细胞的活化和抗肿瘤免疫反应
清华大学生命科学学院江鹏、武汉科技大学祝海川、北京大学张新祥为论文共同通讯作者。清华大学生命科学学院博士后程洁、博士生严金鑫、北京大学化学与分子工程学院博士后刘莹和武汉科技大学生命科学与健康学院史江舟为论文共同第一作者。
江鹏课题组近期代表性研究成果:
Nature Chemical Biology:江鹏/张新祥团队发现延胡索酸调控B细胞的机制和功能
Nature Metabolism:江鹏/杜文静团队揭示苹果酸酶代谢调控突变体p53蛋白的稳定性
Nature Communications:江鹏团队发现p53调控肿瘤细胞存活新机制
Nature:江鹏团队发现p53调控肿瘤新机制——抑制尿素循环
论文链接:https://doi.org/10.1016/j.cmet.2023.04.017































