2022年5月20日,美国Athersys公司宣布,其合作伙伴Healios在日本开展的干细胞治疗缺血性卒中的临床试验未能达到2/3期试验的主要终点。值得一提的是,患者虽在90天时未达到主要终点,但一年后,患者生活质量得到了持续的改善。
缺血性卒中一直是干细胞治疗的研究热点。这篇文章从细胞种类、细胞剂量、干预时间窗、给药的路径和和患者类型等诸多方面进行剖析,希望带给大家更多的思考。
- 01 -
缺血性卒中的干细胞治疗
缺血性卒中概述
卒中俗称“中风”,主要分为缺血性卒中和出血性卒中,其中以缺血性卒中为多。缺血性卒中(Cerebral ischemic stroke),又称脑梗死、缺血性中风,是指脑部血液供应障碍所导致的局部脑组织缺血、缺氧性坏死,进而出现相应神经功能缺损的脑血管疾病。
由于治疗时间窗等因素限制,目前仅有10%左右缺血性卒中患者能在急性期获得溶栓、取栓等血管再通治疗。
图1.缺血性脑卒中示意图
临床试验常用细胞类型
缺血性卒中一直是干细胞治疗的研究热点。不同的缺血性卒中临床试验,需要选择不同的干细胞。目前,最常用的细胞当属间充质干细胞(MSCs)和神经干细胞(NSC)。此外,早期的一些临床探索还使用到造血干细胞(HSC)、嗅鞘细胞(OEC)和单个核细胞(MNC)。
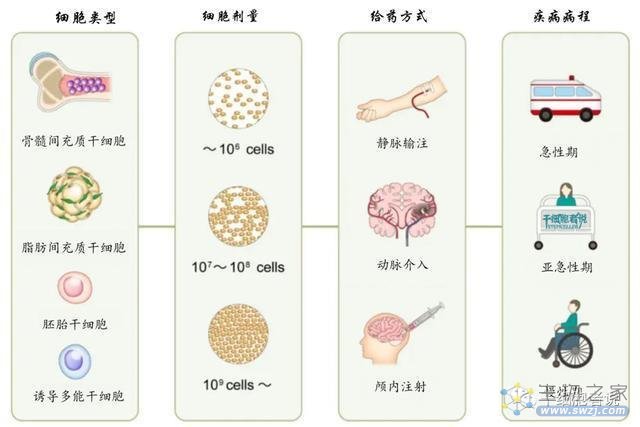
图2. 干细胞治疗缺血性卒中的挑战
临床前研究表明,不同类型细胞均可能改善脑卒中后的神经功能缺损,并且有些已经在临床试验中得到了有益结果。然而,如何选择最佳细胞类型、细胞剂量、移植途径和患者类型等诸多问题,值得我们一起思考。
- 02 -
不同干预窗口期的干细胞临床试验
根据美国临床试验数据库(Clinicaltrials.gov)注册登记,一共检索到43项已注册的干细胞治疗卒中临床试验。根据疾病进程,临床试验分为急性(卒中发作后1周内治疗)、亚急性(卒中发作后1周至6个月治疗)和慢性(卒中发作后6个月治疗)。
不同临床试验设计,各方面差异也很大。细胞类型方面,自体骨髓干细胞最多。细胞剂量大约在1×10*6 ~ 1×10*9之间,细胞移植途径包括静脉给药(IV)、动脉给药(IA)、鞘内给药或脑室内给药(IT)和颅内(IC)给药途径。血管给药(IV和IA)比颅内给药(IC)的细胞数量更高 (10*9 VS 10*6-7)。其理由是颅内移植需要限制细胞的数量,以避免产生占位效应。静脉移植似乎更适合急性期至亚急性期,而颅内移植或鞘内移植大多在慢性期进行。至于评估方式,一般采用修正Rankin量表(mRS)、国立卫生研究院卒中量表(NIHSS)和Barthel指数。
这里需要说明的是,以上临床试验大多是处在早期阶段,也没有设立对照组或对照组比较粗糙。除一项研究外,其他研究均未报道细胞治疗对人体产生不利影响,这倒是证明了干细胞疗法的安全性。
▉急性期
急性期的治疗:指中风发作后一周内的细胞移植。细胞种类一般选择骨髓单个核细胞(BMNC)或异体骨髓间充质干细胞(BMSCs)。临床试验使用静脉给药或动脉给药,不使用脑内给药。在这段时间内,治疗效果主要依赖自身恢复,这强烈影响最终结果,在评估时应予以考虑。
根据临床试验结果分析,在24-36小时(临床试验纳入24 - 48小时)接受干细胞治疗,一年后运动恢复有显著改善。研究说明:急性期接受异体骨髓间充质干细胞(BMSCs)静脉输注治疗的患者可获益。目前,在24-36小时窗口期使用BMSCs的临床试验正在日本进行。
▉亚急性期
亚急性治疗:指中风发作后一周到6个月的细胞移植。细胞种类一般选择骨髓单个核细胞(BMNC)或经扩增的自体骨髓间充质干细胞(BMSCs)。临床试验使用静脉给药或动脉给药,也有使用鞘内移植的。
根据临床试验结果分析,小样本试验报告良好,而较大的随机试验显示各自不同的疗效,并不一致。
Prasad等开展了一项随机对照,多中心联合的 II 期临床试验。试验入组 118 名患者,其中一半患者在损伤后 7-10 天接受了大约 3×10*7 自体 BMNCs。结果显示,静脉输注 BMNCs 是安全的,但对卒中结局没有任何有益的影响。
Lee等报道,与随机对照相比,经静脉注射 1×10*8 个 BMSCs 治疗开始后,卒中患者可在 5 年内获得更好的恢复并降低死亡率,而 Jaillard等人并未报道整体受益。动脉给药治疗的结果在不同的试验中也不同。
Bhatia等报道,通过动脉给药自体 BMNCs 良好的恢复趋势(P = 0.06),而其他研究没有报道这种差异。
▉慢性期
慢性期治疗:指缺血性卒中6个月后的细胞治疗。目前,有效的治疗流程还在摸索中。颅内给药方式较为常用。也有研究报道了CD34+HSC的颅内移植与对照组相比,存在明显的神经恢复。虽然入组患者数量很少(N = 6个),但与对照组相比,颅内给药注射的恢复效果更好。静脉给药的结果,则显示各自不同的疗效,并不一致,有的有显著恢复,有的则没有。
- 03 -
如何看待干细胞治疗缺血性卒中
干细胞治疗的各种成功因素中,细胞种类的选择固然很重要,细胞产品的质量也不可或缺,还应对适应症本身有透彻的了解,同时采用正确的给药途径,以及给予合适的剂量。
下面,我们针对各种因素逐一阐述。
▉如何选择干细胞类型
临床试验用于缺血性卒中治疗的细胞类型,包括MNC、MSCs、OEC、NSC和iPSC。另外,还有基因修饰的细胞(旨在通过增强细胞因子的释放和细胞存活时间进行治疗)。
一般而言,自体细胞(包含MNC、MSCs、OEC)具有移植后排斥反应低和风险低的优势,而同种异基因细胞(MSCs、NSC)则具有规模化和标准化的优势。“现货型”同种异基因细胞产品已成为未来发展趋势。开发“现货型”同种异基因细胞产品,必须考虑几个因素(如安全性、效率、成本和规模化生产)的可行性。其中,产品异质性是个很大问题。采用不同的生产工艺,即使来自同一供体的干细胞,也可能表达不同的功能和分子表型。
▉如何选择给药途径
合适的给药方式,也是干细胞临床转化成功的一个重要挑战。在干细胞治疗缺血性卒中的临床设计中,如何将干细胞输送到目标脑区的方式至关重要。
静脉输注由于操作简便、侵袭性小、可重复性强,所以临床治疗中较为常见。比起局部给药,静脉输注的干细胞,由于靶点距离较远,大多数细胞被困在肺部,归巢性往往不足,从而影响治疗效果。静脉给药治疗的有益作用是通过减少细胞凋亡和减轻炎症来实现的。这在缺血性卒中的急性期是有用的,但在慢性期可能就没有多少益处了。
一般而言,在大剂量给药方面,动脉给药优于静脉给药。然而,动脉给药对脑内并不适用。颅内动脉给药的一个缺点是,细胞团阻塞动脉会造成额外的缺血性损伤。脑室内给药,可将大量细胞送入蛛网膜下腔,侵袭性较小。脑实质直接注射,实现了最高水平的细胞植入,侵袭性较大,而且注射针可能造成额外脑损伤的风险也应该考虑。
▉移植后的细胞行踪
在急性期和亚急性期,首选静脉给药和动脉给药,使用细胞量较大,最多可达10*9个细胞。而在慢性期,首选较少细胞剂量10*7个细胞的颅内给药。有趣的是,临床试验显示大多数经血管给药(动脉给药或静脉给药)后的干细胞并不存在于大脑中,而是存在于肺、脾和膀胱等器官中。
Rosado-de-Castro等人将锝99m标记的 BMNCs 通过静脉和动脉内给药移植到亚急性脑卒中患者,发现在移植后2-24小时,只有0.6% - 0.9%的细胞存在于大脑中。动脉给药后,在肝脏(2h: 40%和24h:47%)和脾脏(2 h: 6%和24h:7%),肺部较少(2h:7%和24h:4%)。而静脉给药后,肝脏(2h:14%和24h:19%)和脾脏(2h:2%和24h:3%),肺部(2h:21%和24h:7%)。结果显示,干细胞移植后,静脉给药和动脉给药的细胞的分布不同。随后,静脉给药的细胞分布在肺内,而动脉给药则分布在肝脏内。
其他报道经动脉给药锝99m标记的BMNCs的研究结果也相似,后者在缺血2小时后出现在脑内,主要富集在肝脏、肺、脾脏、肾脏和膀胱。24h后,颅内细胞几乎不可见,其他器官仍可富集。结果表明,静脉给药或动脉给药的细胞,不能在大脑中停留很长时间。
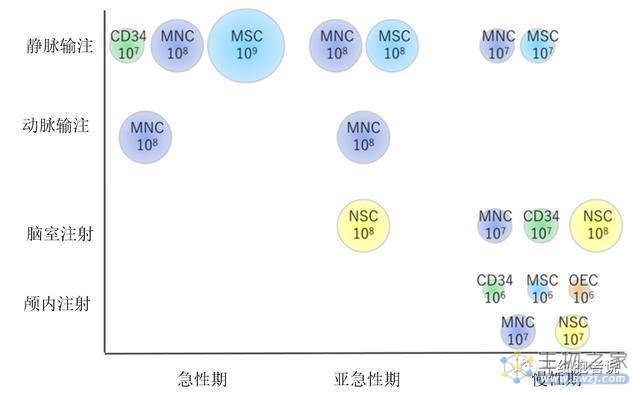
图3. 细胞类型、剂量和患者特征之间的关系
结论:急性期首选静脉移植,细胞量较大,;而慢性期首选颅内移植,细胞量较少。
- 04 -
小结和展望
缺血性卒中的治愈,一直是再生医学领域的难题。干细胞移植是治疗缺血性卒中最有前景的方法之一。临床试验的结果表明,大多数干细胞移植是安全的,但有效性方面参差不齐,而干细胞治疗缺血性卒中更多的临床试验已经在路上。
▉国际开展的临床试验概况
最后,我们看一下国际上开展干细胞治疗缺血性卒中的临床试验汇总表。
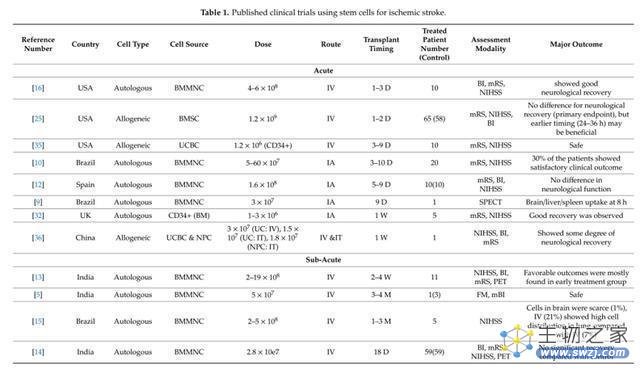
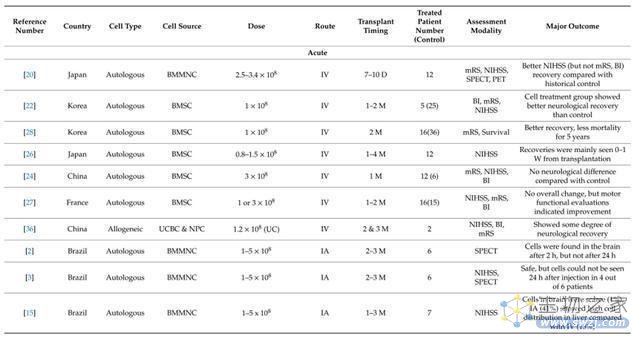
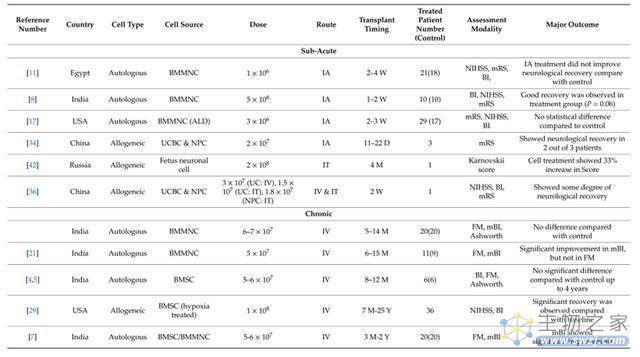
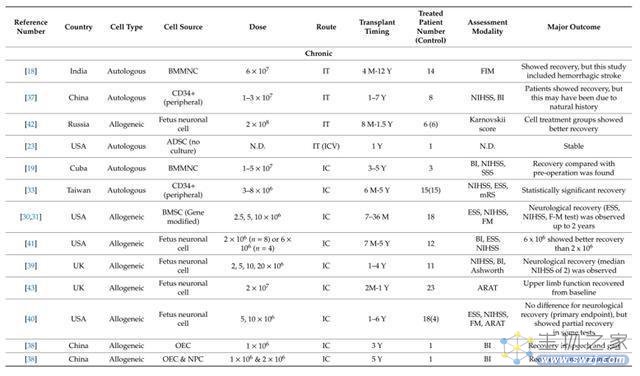
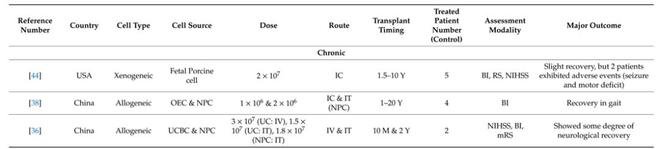
图4.国际上开展干细胞治疗缺血性卒中的临床试验汇总
一、在急性期的临床试验。一般选择静脉或动脉回输。治疗作用机制:通过间接方式保护神经元的健康和生存。有益作用是通过减轻炎症来实现的。细胞类型可选择:间充质干细胞(MSCs)、单个核细胞(MNCs)等。
二、在慢性期的临床试验。一般选择颅内或鞘内移植。治疗作用机制:细胞替代移植被认为是细胞治疗的主要机理。细胞移植长期存活较困难,任重道远。细胞类型可选择:神经干细胞(NSC)、嗅鞘细胞(OEC)、诱导多能干细胞衍生细胞、胚胎干细胞衍生细胞。
国内也已经有机构正在积极开发治疗缺血性卒中的干细胞药物。临床试验阶段有三个,包括九芝堂美科的“缺血耐受人同种异体骨髓间充质干细胞”、呈诺再生医学的“异体内皮祖细胞(EPCs)注射液”、爱萨尔生物的“人脐带间充质干细胞注射液”。此外,霍德生物开发的iPSC衍生临床细胞产品,也在积极申请IND的路上。
关山难越,任重道远。我们既不要过早的宣布胜利,也不要过早的放弃一个有希望的治疗策略。任何事物的发展都将遇到挑战和阻碍,我们仍然相信干细胞治疗将克服困难,成为可靠的治疗方式。
主要参考文献
Masahito Kawabori, Hideo Shichinohe, Satoshi Kuroda, Kiyohiro Houkin.Clinical Trials of Stem Cell Therapy for Cerebral Ischemic Stroke. Int. J. Mol. Sci. 2020, 21, 7380; doi:10.3390/ijms21197380
Barker, R.A.; Gotz, M.; Parmar, M. New approaches for brain repair-from rescue to reprogramming. Nature 2018, 557, 329–334.
Misra, V.; Ritchie, M.M.; Stone, L.L.; Low,W.C.; Janardhan, V. Stem cell therapy in ischemic stroke: Role of IV and intra-arterial therapy. Neurology 2012, 79, S207–S212. [
Li, J.; Zhang, Q.; Wang, W.; Lin, F.; Wang, S.; Zhao, J. Mesenchymal stem cell therapy for ischemic stroke: A look into treatment mechanism and therapeutic potential. J. Neurol. 2020.
Kuroda, S.; Shichinohe, H.; Houkin, K.; Iwasaki, Y. Autologous bone marrow stromal cell transplantation for central nervous system disorders—Recent progress and perspective for clinical application. J. Stem Cells Regen. Med. 2011, 7, 2–13.
Cui, L.L.; Golubczyk, D.; Tolppanen, A.M.; Boltze, J.; Jolkkonen, J. Cell therapy for ischemic stroke: Are dierences in preclinical and clinical study design responsible for the translational loss of ecacy? Ann. Neurol. 2019, 86, 5–16.
Anna Andrzejewska, Sylwia Dabrowska, Barbara Lukomska, Miroslaw Janowsk. Mesenchymal Stem Cells for Neurological Disorders. Adv. Sci. 2021, 8, 2002944































