癌症代谢重编程取决于内在的肿瘤特性(驱动突变、起源组织和阶段)和其微环境的限制,最近的工作指出肿瘤和免疫细胞之间的代谢竞争为肿瘤创造了一个免疫抑制或耐受的微环境(TME)。因此,更好地了解癌细胞利用营养物质的性质以及用于维持肿瘤生长的代谢途径是很重要的。肺癌是全世界癌症死亡的主要原因,非小细胞肺癌(NSCLC)约占85%,KRAS的激活突变发生在30%的NSCLC病例中,体外培养的突变KRAS驱动的肿瘤细胞在体外会发生特定的代谢后果,但评估KRAS驱动的肺部肿瘤发生早期代谢改变的临床前研究仍然很少。已有工作证明在同一KRAS驱动的肺癌小鼠模型中,饮食控制发挥了强大的抗肿瘤作用,表明这种类型的肿瘤对代谢变化很敏感。此外,一项对改变血脂疗法的Meta分析显示血浆高密度脂蛋白-胆固醇(HDL-C)水平增加与癌症发病风险降低36%有关【1, 2】。然而,HDL-C在癌症发展中的具体作用仍不清楚。
为了证明血浆HDL-C增加与肿瘤生长受控之间的联系,2023年6月1日,来自法国蔚蓝海岸大学(Université Côte d’Azur)的Laurent Yvan-Charvet团队在Cell Stem Cell杂志上发表了一篇题为 Cholesterol efflux pathways hinder KRAS-driven lung tumor progenitor cell expansion 的文章,他们构建了一个由致癌性KRAS突变驱动的肺癌小鼠模型,发现上皮祖细胞中胆固醇外流途径缺陷是早期NSCLC病变发展的罪魁祸首,而过度表达脂蛋白A-I(apo-AI)来提高高密度脂蛋白(HDL)水平可以保护小鼠免受肿瘤进展引起的病理后果,用环糊精清除胆固醇可以通过抑制肿瘤来源的上皮祖细胞的扩增来缓解肿瘤进展。总之,这项工作指出可以将胆固醇清除疗法作为靶向阻断肺癌祖细胞的策略。

研究人员首先构建了KrasG12D驱动的肺癌小鼠模型,并将其与对照小鼠的全肺组织在肺癌出现6周后酶解以进行scRNA-seq分析。与正常肺相比,肺癌小鼠的巨噬细胞和上皮祖细胞内参与脂质和胆固醇代谢通路下调,结合小鼠摄入[3H]胆固醇24小时后肺癌小鼠的肺部表现出更高的[3H]胆固醇积累,而血浆中HDL-C水平下降的数据,作者认为胆固醇外流途径可能受损。已知HDL及其最主要的载脂蛋白apo-AI促进胆固醇从细胞中的流出,也部分取决于ATP结合盒转运蛋白ABCA1和ABCG1,基于此,作者构建了上皮细胞特异性ABCA1/ ABCG1基因敲除小鼠,并未出现自发性病变,随后与KrasG12D肺癌小鼠(以下简称为CC-LR小鼠)杂交得到上皮特异性ABCA1/ ABCG1缺陷的肺癌小鼠(以下简称CC-LRDKO小鼠)。与CC-LR相比,CC-LRDKO小鼠中能观察到类似数量的肿瘤结节和增生,但大小却明显增加,且上皮祖细胞出现弥漫性扩增。流式分析显示胆固醇外流途径受损限制了嗜酸性粒细胞等髓系细胞的浸润,这可能反映了一种促免疫耐受的TME。这些数据提示上皮肿瘤祖细胞中的胆固醇外流途径缺陷驱动了肺部肿瘤患者KrasG12D小鼠的肿瘤生长。
接下来,作者想知道人apoA-I过表达对KrasG12D肺癌小鼠高密度脂蛋白介导的胆固醇外流增加的影响。首先,携带apoA-I转基因的小鼠存活时间更长,H&E染色显示肿瘤诱导8周后,肺组织胆固醇积累减少,上皮祖细胞扩增受抑制,且肺部ki67阳性增值细胞也明显减少,提示肿瘤进展确实被apoA-I转基因显著阻断。为了确认胆固醇外流途径的调节是否可以对已存在的肿瘤有治疗益处,作者将已有肿瘤的小鼠每周暴露于一次bCD(甲基-β-环糊精),4周后对肺部进行显微镜检查。尽管病变大小相似,但bCD治疗限制了进展期肿瘤的结节数量以及上皮祖细胞的扩增,说明胆固醇清除疗法可以减少KrasG12D肺癌小鼠的肿瘤进展负担。
为了证明上述发现是否适用于肺癌患者,作者筛选了LPCE库中22名不同阶段的人类肺腺癌(LUAD)患者并检测他们血浆中的HDL-C和apoA-I水平,与对照组相比,HDL-C水平降低约25%和50%。随后,作者对57个LUAD样本和11个正常肺组织进行RNA-seq分析,碳水化合物代谢、TCA循环、氧化磷酸化(OXPHOS)和氨基酸代谢相关通路明显上调,而与磷脂、鞘脂、胆固醇等代谢相关的转录本下调。作者在一个更大的包含399名患者的队列中进一步验证发现一致的代谢通路富集特征,且胆固醇代谢相关转录物在LUAD中下调最多。
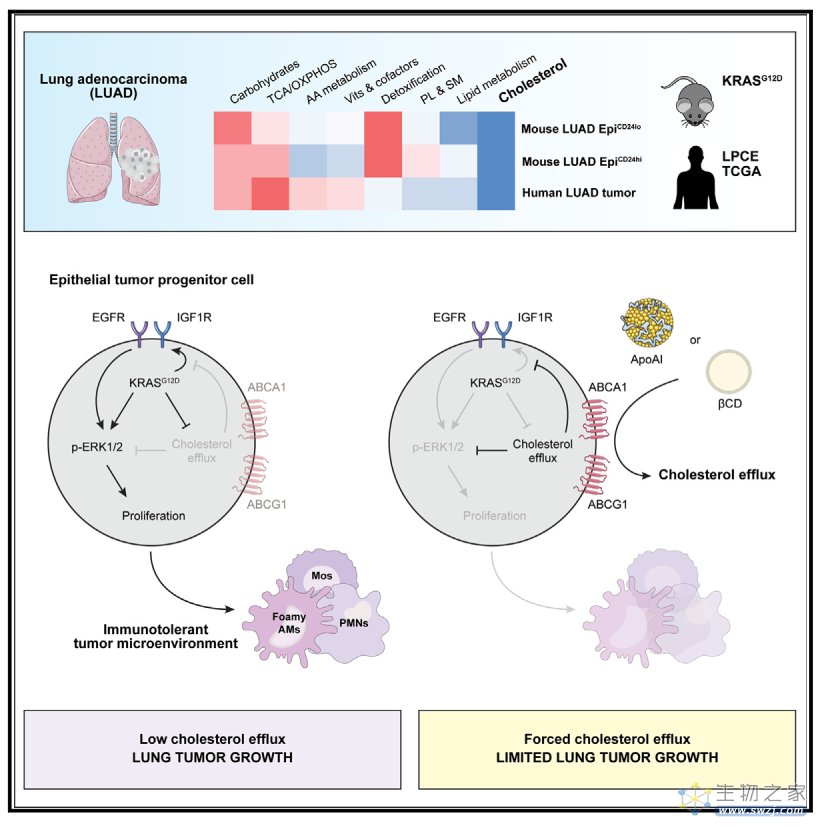
总之,基于上述研究发现,该工作指出提高HDL或用bCD清除胆固醇可能是一种限制KRASG12D肺癌进展的潜在有效策略。
原文链接:https://doi.org/10.1016/j.stem.2023.05.005
参考文献
1.Ramadori, G., Konstantinidou, G., Venkateswaran, N., Biscotti, T., Morlock, L., Galie´ , M., Williams, N.S., Luchetti, M., Santinelli, A., Scaglioni, P.P., et al. (2015). Diet-induced unresolved ER stress hinders KRAS-driven lung tumorigenesis. Cell Metab. 21, 117–125. https://doi.org/10.1016/j.cmet.2014.11.020.
2.Pirro, M., Ricciuti, B., Rader, D.J., Catapano, A.L., Sahebkar, A., and Banach, M. (2018). High density lipoprotein cholesterol and cancer: marker or causative? Prog. Lipid Res. 71, 54–69. https://doi.org/10.1016/j.plipres.2018.06.001.































