
十年前,年仅20岁的张安琪,因“门萨女孩”、“复旦学霸”的标签而火遍全网。此后,她前往哈佛大学读博,低调的科研生活让曾经的网络热度逐渐散去。
十年后的2023年7月20日,张安琪再次受到关注,但这一次不再是因为那些浮华的标签,她作为第一作者兼共同通讯作者在国际顶尖学术期刊 Science 上发表了一篇重磅研究论文【1】,开发出了一种微型、超柔性的血管内神经探针,可以植入啮齿动物大脑中直径小于100微米的血管中。这项研究为无需开颅手术、不损伤大脑或血管的微创脑机接口临床转化奠定了基础。
在不到一个月时间里,张安琪又在 Science Advances 期刊发表论文【2】,为研究活体动物的大脑神经网络带来了新方法——下一代基因靶向化学组装(GTCA)。

2023年8月9日,斯坦福大学 Karl Deisseroth 教授与鲍哲南教授团队(张安琪博士为第一作者)在 Science Advances 期刊发表了题为:Genetically targeted chemical assembly of polymers specifically localized extracellularly to surface membranes of living neurons 的研究论文【2】。
该研究开发了下一代基因靶向化学组装(GTCA)方法,通过高度定位表达辣根过氧化物酶(HRP),靶向原代神经元的质膜,具有最小程度的细胞内保留。通过这种方法可在目标细胞膜外特异性原位合成聚合物,并且这些神经元仍能存活且保持活力。此外,该方法具有普适性,很容易扩展到将多种不同材料结合到活体组织中特定细胞膜外表面,有望进一步实现下一代生物界面。
我们常说,人类大脑是宇宙中最复杂的结构,人类大脑包含约860亿个神经元,它们之间有超过100万亿个突触连接,这些突触连接对于神经元之间的交流至关重要。几十年来,科学家们一直努力将生物电子设备的尺寸缩小到纳米级,并提高制造工艺,但到目前为止,为大脑设计的设备通常一次只能与数百个细胞连接,并且无法与组织实现细胞类型特异性整合。
解决这一问题的一种方法是在完整的生物系统中对特定细胞进行遗传编程,以原位构建具有所需形式和功能的人工结构。导电聚合物可以通过电化学聚合直接在活组织细胞上合成,也可以在具有天然氧化环境或氧化酶的生物体和组织中合成。但这些方法都不能实现细胞类型特异性这一关键目标。
2020年3月,鲍哲南教授、Karl Deisseroth 教授团队(刘嘉博士为第一作者)在 Science 期刊发表论文【3】。
该研究开发了一种名为基因靶向化学组装(GTCA)的新方法,将抗坏血酸过氧化物酶Apex2作为催化剂在神经元中表达,用于引发过氧化氢(H2O2)激活具有导电特性的高分子聚合物在神经元上的原位合成。电生理和行为分析证实,这些功能聚合物的基因靶向组装不影响神经元的生存和天然功能,能够重塑膜特性和调节特定细胞的行为。该研究在活体生物中构建具有细胞特异性的复杂功能性结构和材料迈出了第一步。

张安琪表示,这项研究尽管取得了初步成功,但也存在着一个主要限制——Apex2并非只特异性靶向质膜的细胞外侧,大部分的Apex2保留在了细胞内。而开发出一种能够有效地将反应中心完全放置在细胞外空间(质膜外侧)的方法,对于创建创建生物制造平台的进一步应用至关重要。
之所以要将反应中心完全放置在细胞外空间,有以下几点原因:
首先,较大的反应前体或者材料可能很难渗透到具有完整细胞膜的活细胞内部,因此,酶的膜展示不足可能导致系统中化学组装产量低;
其次,利用细胞外空间增加催化反应的酶数量,可以降低设定反应条件的试剂(比如H2O2)的浓度,从而提高生物相容性;
第三,细胞内聚合反应可能对细胞有毒,诱导细胞凋亡,细胞外空间的局部反应可能降低潜在毒性作用;
最后,除了膜定位以外,还有其他方法来推进该技术的进步,例如Apex2酶没有针对细胞表面的应用进行优化,而另一种过氧化物酶——辣根过氧化物酶(HRP),催化与Apex2相同的反应,且具有更快的动力学和更强的抗H2O2诱导失活的能力。
在这项最新研究中,研究团队开发了下一代基因靶向化学组装(next-generation GTCA)方法用于靶向聚合物组装,该方法使用的辣根过氧化物酶(HRP)高度定位于原代神经元的质膜上,具有最小程度的细胞内保留。
通过这种方法能够在目标神经元膜周围的细胞外密集合成高分子聚合物,并且这些神经元在急性聚合后仍能存活且保持活力。此外,这种膜定位方法被证明很容易适用于锚定其他蛋白质,从而可以探索多种GTCA的替代策略。
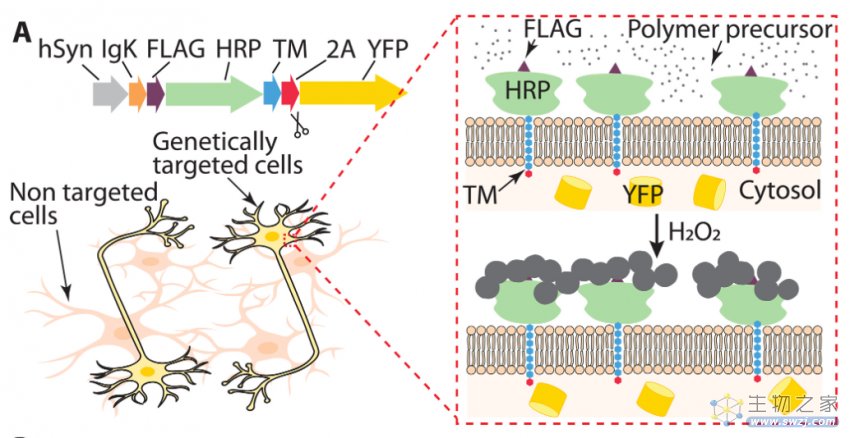
神经元中下一代GTCA的原理图
张安琪告诉《生物世界》,在这项工作的基础上,自己还在计划尝试在细胞膜上测试其他反应条件,构建不同的材料,调控不同类型的细胞。在应用方面,首先,上一代GTCA已经初步实现了神经元活动的调控,而现在通过改进的下一代GTCA,希望可以更精确地调控神经元活动,用来治疗一些神经系统失调导致的疾病,例如自闭症等。其次,希望可以通过GTCA来实现从细胞膜上长出电极,这些电极可以将相邻的神经元连接起来,在大脑里人工“写出”新的神经回路;也可以用来高精度测量神经细胞的活动。
实际上,张安琪接连发表的这两项研究成果还能有所结合,张安琪表示,在 Science 发表的血管内神经探针可以实现测量和调控血管壁外的神经元活动,但是它没有细胞类型特异性;而下一代GTCA可以有选择性地在特定细胞膜上实现化学组装,让某些特异性神经元更容易或者更难被刺激。这两项技术可以结合,使得血管内神经探针有选择性地调控神经活动。
2014年从复旦大学本科毕业后,张安琪前往哈佛大学读博,师从 Charles Lieber 教授(国际纳米科学先驱、美国四院院士)。2020年博士毕业后,张安琪加入斯坦福大学从事博士后研究,师从鲍哲南教授(材料科学顶尖学者,斯坦福大学化学工程学院院长)、Karl Deisseroth 教授(光遗传学之父)。张安琪表示,三位导师各有专长,这些年在这几个实验室的学习和训练让有了很多信心,希望能把这些方向结合起来,在未来实现脑机接口的临床应用。
论文链接:
1. https://www.science.org/doi/10.1126/science.adh3916
2. https://www.science.org/doi/10.1126/sciadv.adi1870
3. https://www.science.org/doi/10.1126/science.aay4866































