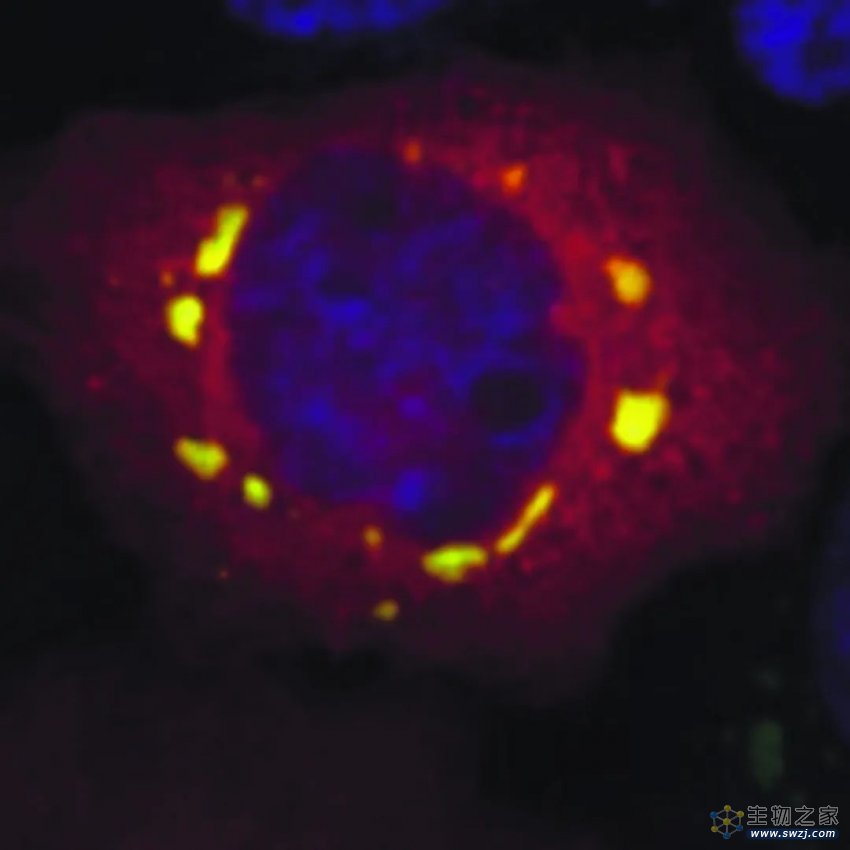
应激颗粒(黄色)像太阳系的星星一样环绕在细胞核(蓝色)周围。课题组供图
生命的活力有赖于健全的防御机制,小小细胞也是一样。防御机制一旦出现差错,细胞就会变得脆弱甚至导致疾病。
浙江大学医学院脑科学与脑医学学院白戈研究员课题组与中国科学院分子细胞科学卓越创新中心李劲松院士课题组开展合作研究,发现导致应激颗粒异常的一种关键分子机制:参与应激颗粒形成的核心蛋白被致病蛋白“绑架”,应激颗粒的组分发生改变,其抗压功能严重受损。
该研究进一步揭示了应激颗粒异常是导致多种不同亚型腓骨肌萎缩症的共性机制。这为针对这类神经罕见病的广谱治疗药物开发提供了理论基础,也为其他神经退行性疾病的机制研究提供了新思路。2月3日,相关成果以封面论文的形式在线发表于《细胞》。审稿人评价该论文的发现重要且新颖,将改变这个领域的思维方式。
应激颗粒的作用不容小觑
细胞的一生常常会面临各种应激。当危险来临,细胞会暂停胞浆内的蛋白翻译,将未翻译的信使核糖核酸(mRNA)和部分蛋白“打包压缩”成一个个小颗粒保护起来。
这些尺寸在0.1至2微米左右的球状小液滴被称为应激颗粒(SG),它们像太阳系的行星一样环绕在细胞核周围。此时细胞会将大量的“人员”转移到安全的地方。待到危机解除,应激颗粒则会发生“解压缩”而功成身退,帮助细胞恢复正常运转。
“应激颗粒可以有效避免应激状态下蛋白的错误翻译,组织利用细胞中的各种信号分子和能量资源,使细胞更好应对环境中的不良刺激,提高细胞存活率。”论文共同通讯作者白戈介绍,作为细胞内一个重要的防御机制,应激颗粒的作用不容小觑。
研究表明,疾病蛋白在应激颗粒中聚集并产生蛋白沉淀是导致渐冻症、阿尔茨海默病等多种神经退行性疾病的一个重要机制。
白戈平时关注一类名为腓骨肌萎缩症的遗传性周围神经病。患者通常从青少年阶段开始发病,表现为四肢远端进行性肌无力和肌萎缩并伴有感觉障碍。“包括腓骨肌萎缩症在内的一部分神经系统疾病中并没有发现病理性蛋白沉淀。”这让白戈感到疑惑,“这些细胞的应激颗粒是否存在异常呢?”
之前发表的一项研究为白戈提供了重要线索。相关功能性研究表明,当细胞内敲除G3BP蛋白后,面临不良环境刺激时细胞无法形成应激颗粒,增加了细胞的死亡率。
“绑架”核心蛋白
在正常情况下,G3BP蛋白均匀分布于细胞质中。而在应激情况下,G3BP蛋白“临危受命”,作为核心组分组装形成应激颗粒,众多蛋白和核糖核酸(RNA)与之“抱团”,形成一个复杂的蛋白-RNA交互网。在显微镜下,可以看到细胞内部的物质发生了液-液相分离现象,星星点点的蛋白“抱团”成液滴样的应激颗粒。
“当致病蛋白出现在这张网络中,应激颗粒会发生什么变化?”白戈说,他们以2D型腓骨肌萎缩症(CMT2D)中的突变蛋白GlyRS为切入点,探索应激颗粒内部网络的变化。
通过实验,白戈课题组发现,在应激状态下,野生型和突变型GlyRS蛋白都能够进入应激颗粒中,但只有突变型GlyRS蛋白能够与G3BP发生异常的相互作用,扰乱以G3BP为中心的应激颗粒网络。进一步研究显示,突变的GlyRS蛋白导致应激颗粒网络互作强度增加,形成了结构更为致密的颗粒。
“GlyRS突变蛋白与G3BP的异常相互作用不会影响应激颗粒组装-解聚的动态变化,却会显著干扰以G3BP为核心的应激颗粒蛋白网络,导致大量非应激颗粒组分异常滞留在应激颗粒中,从而扰乱了细胞正常的应激反应。”白戈说,应激颗粒受损会导致运动神经元抵御外界不良环境刺激的能力明显下降,更易发生轴突退变。
研究人员指出,遗传突变会导致GlyRS蛋白质构象发生改变,开放出新的结构域,使其获得了异常的蛋白结合活性。这个开放结构域的存在,导致突变后的GlyRS蛋白更容易和G3BP发生异常结合,使颗粒更加致密。在腓骨肌萎缩症小鼠模型中,破坏这种异常的相互作用可以挽救应激颗粒异常并缓解小鼠的运动缺陷。
发现“隐蔽”共性机制
白戈课题组的研究揭示了腓骨肌萎缩症中,一个基因突变如何引起应激颗粒的功能受损,进而导致疾病发生的分子机制。这是一个极为“隐蔽”的机制。因为从表面上看,这些受损的应激颗粒组装-解聚的动态过程没有异常,也不产生病理性的蛋白沉淀。病变机制隐藏在核心蛋白的网络结构中。遗传突变导致突变蛋白与应激颗粒核心蛋白形成了异常相互作用,应激颗粒的组分发生改变并形成致密颗粒,最终导致了细胞抗压机制的失灵。
作为临床上常见的周围神经遗传病,腓骨肌萎缩症的发病率约为1/2500。根据致病基因的不同,其可以分为几十种不同的亚型,目前仅CMT2一个亚型就有30个以上不同的致病基因。也就是说,腓骨肌萎缩症几十种不同的亚型,其致病基因各不相同,却能导致相似的临床表现,医学上这一现象被称为“遗传异质性”。
这些不同的致病蛋白在细胞中的定位和功能各异,为相关治疗药物的开发带来了极大挑战。如果科学家能从中找到共性的发病机制,就有可能实现利用一种药物对多种亚型的腓骨肌萎缩症进行治疗。
在这项研究中,研究人员对25种腓骨肌萎缩症相关突变蛋白进行了考察。结果发现,在受到环境压力的情况下,14种突变蛋白会被招募到应激颗粒中,其中有12种蛋白与G3BP的相互作用发生了改变,导致应激颗粒的功能受损。
“在环境刺激下进入应激颗粒,可能是不同突变蛋白存在的一个共性特征。”论文共同第一作者崔琴琴说,“突变蛋白进入应激颗粒后,可能以多种方式影响应激颗粒的功能。”
这种共性机制为针对多种亚型腓骨肌萎缩症的广谱治疗药物开发奠定了重要的理论基础。
相关论文信息:https://doi.org/10.1016/j.cell.2022.12.046































