彩色玉米不仅在口感上有其独特的风味,在视觉上也对食客们具有独特的吸引力。但你可能没有注意到,不仅是玉米粒与玉米粒之间,存在着五彩斑斓的颜色,单一颗玉米粒上,也可能存在着斑斑点点,而就是这些小小的斑点,引出了20世纪遗传学史上堪称与DNA双螺旋结构并列的另一项重大发现——转座子(transposable elements,TE)。
转座子又称跳跃基因,顾名思义,就是这段基因能够在染色体上发生跳跃,从染色体的一个位置跳到另一个位置,甚至跳到另一条染色体上。这一在当时看起来惊世骇俗的学说由美国遗传学家Barbara McClintock提出。当时,她发现玉米籽粒的色素遗传具有不稳定性,为此,她展开了长达六年的研究,最终发现了“Ac-Ds调控系统”。在这一系统中,Ac和Ds就是两种不同的转座子,Ac能够独自完成跳跃,而Ds需要在Ac的帮助下才能进行跳跃。

图1 Barbara McClintock(图源:维基百科)
具体来说,色素合成基因正常工作时,玉米籽粒呈现糊粉层的紫色;当Ds跳入色素合成基因的中间时,色素合成基因失活,糊粉层透明,玉米籽粒呈现胚乳的黄色;然而还有的时候,Ds会在Ac的影响下,在色素合成基因中跳进跳出,最终导致玉米籽粒出现色素斑点。
Barbara的发现在当时并没有立刻得到学术界的认可,然而时间会给出正确的评价。1983年,Barbara凭借对转座子的开创性研究以81岁的高龄获得了诺贝尔奖。
现在我们知道,转座子甚至构成了许多真核生物基因组的极大部分内容。比如人类,基因组中就有接近一半都是转座子。而玉米、大麦、小麦等的基因组中转座子比例超过85%。转座子的存在,使得基因组更容易发生改变,加速了物种的进化过程,可以说没有转座子,就没有今天五彩纷呈的各色生命。不过,转座子的起源仍然是一个谜,有人认为它可能源自于细菌或病毒,也有人认为,转座子是随着真核生物进化而出现的。
目前,科学家利用转座子的特性,在基因组编辑、基因表达研究、分子进化研究和植物育种等方面展开了多种应用。比如近期,我们曾在《张锋团队再发Science:又一种新的基因编辑工具要来了?》一文中报道,张锋团队就提出可以利用家蚕的R2非LTR逆转录转座子作为新型基因编辑工具。
近日,华盛顿大学医学院发表在Nature Genetics上的最新研究“Pan-cancer analysis identifies tumor-specific antigens derived from transposable elements”表明,可以利用各种癌症中的转座子开发出新型的免疫疗法,使得原本那些免疫疗法无可奈何的肿瘤也变得“有隙可乘”。

图2 研究成果(图源:[1])
提到肿瘤,我们通常会想到肿瘤细胞中发生的各种各样的突变,而这些突变的DNA能够使癌细胞产生异常的蛋白质,这就给了免疫疗法攻击的靶点,能够将癌细胞与正常细胞区别开来。尤其是那些突变负荷较高的肿瘤,如肺癌、皮肤癌等,免疫疗法所能产生的疗效会更好。然而,面对一些肿瘤突变负荷较低,免疫系统就有些无用武之地了。
近年来,人们越来越认识到转座子在癌症进展中的作用,并意识到这有可能会成为未来癌症治疗的可靠生物标志物。具体表现为,转座子内部的隐蔽启动子出现普遍的重新激活(即启动子扩展适应,promoter exaptation),这驱动了非典型基因的表达,并导致了广泛地选择性剪接事件。同时,表观遗传失调的转座子产生的转录物会与邻近编码蛋白的基因掺杂在一起,导致生成嵌合RNA产物,即TE嵌合转录物(TE-chimeric transcript)。当这种RNA产物被翻译时,正常的蛋白质前会被添上额外的氨基酸。如果这些肿瘤特异性的嵌合肽可以作为抗原呈现在癌细胞表面,就成为了可以“瞄准”的标靶。
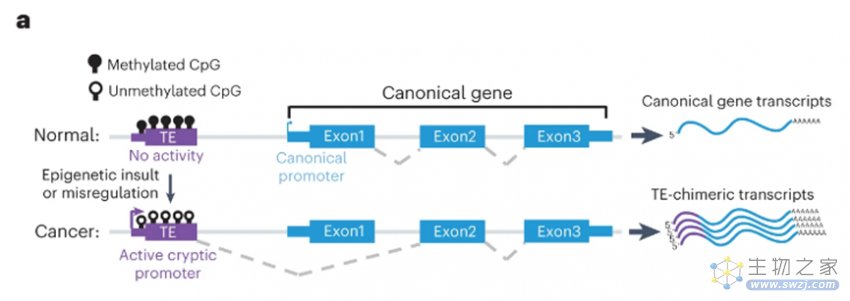
图3 TE嵌合转录物导致正常的蛋白质前添上额外的氨基酸(图源:[1])
不过,要使这一认知真正能有助于临床,还需要对现有的癌症数据库就转座子的表观遗传失调情况进行一次全面、系统的评估。
在这项研究中,研究团队对癌症基因组图谱计划(The Cancer Genome Atlas,TCGA)中的33 种肿瘤类型、基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库中的30 种成体组织以及675种癌细胞系进行了分析。
所有的TCGA肿瘤中鉴定出了TE嵌合转录本
通过分析,研究人员共识别出26816 个TE嵌合转录本,在过滤了正常样本中显著表达的以及其他成人成体组织中表达的转录本后,共筛选出2297 个肿瘤特异性 TE嵌合转录本。研究人员还发现,几乎所有肿瘤(97.9%)都至少存在一种TE嵌合候选物。
遗传/表观遗传事件与TE启动子激活相关
在表观遗传方面,DNA甲基化是限制转座子活性的重要机制,全局甲基化的广泛丧失也是许多癌症的标志。因此,研究人员考察了DNA甲基化水平和TE扩展适应之间的关系。结果发现在21种癌症类型中,有17种表现出了甲基化水平和激活的候选TE嵌合转录本的负相关性。
另外,基因突变本身也可能与TE的激活数量增加有关。在这里,研究人员发现了35种驱动基因和癌症类型的组合,其中激活的候选TE数量存在显著差异。在12癌症类型中,出现在TP53基因中的突变伴随着更多的TE嵌合转录本。
可作为免疫治疗靶点的肿瘤特异性TE嵌合蛋白(Tumor-specific TE-chimeric proteins,TS-TEP)
研究人员对TE嵌合转录本的蛋白质产物进行了预测,并最终确定了1068个TE嵌合转录本的蛋白质产物可能具有抗原性。研究人员将这些蛋白质命名为TS-TEP。总体而言,93.2%的肿瘤样本至少有一个TS-TEP。虽然某些TS-TEP只特定出现于某几种癌症类型,但也存在一些TS-TEP在所有的TCGA癌症类型中出现。
通过预测TS-TEP和HLA分子结合的亲和力,研究人员确定了大多数患者的HLA分子都具有与TS-TEP结合的可能性,即这些TS-TEP具有广泛的免疫识别潜力。后续的实验进一步证实了TS-TEP的抗原确实由HLA-I 在癌细胞系中呈递。一个极富前景的事实是,20种TS-TEP候选物构成的组合可以覆盖27种癌症类型中超过75%的患者。这表明,这些高度共享的TS-TEP有望成为通用的癌症疫苗。
此外,研究人员还证实,TE嵌合转录本可在细胞膜表面产生抗原,这显示了绕开HLA分子呈递,使用基于抗体或CAR-T细胞的潜在治疗可能。
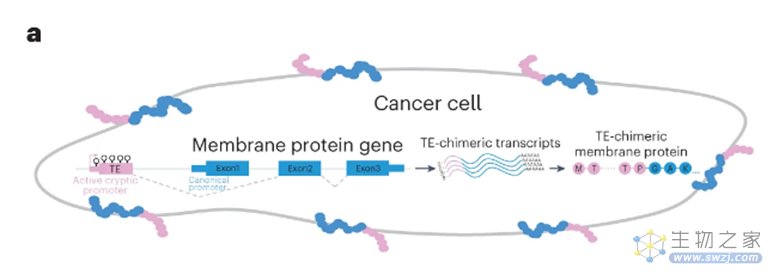
图4 TE 嵌合转录物如何产生膜结合抗原(图源:[1])
研究的资深作者Ting Wang 博士表示:“免疫疗法在癌症治疗上的表现令人瞩目,然而,许多低突变负荷肿瘤类型并不适用。我们的这项研究开辟了一种全新的方法,能够识别从前免疫疗法所看不到的肿瘤抗原。”
Wang表示,团队正在设想一种癌症疫苗,可针对转座子引起的最常见的5种或10种肿瘤蛋白,相信这足以覆盖大部分的肿瘤。虽然还有更多的工作需要完善,但这不失为一个新型癌症免疫疗法的起点。
参考资料:
[1]Nakul M. Shah, H. Josh Jang, Yonghao Liang, et al. Pan-cancer analysis identifies tumor-specific antigens derived from transposable elements. Nature Genetics, 2023; DOI: 10.1038/s41588-023-01349-3
[2]https://medicine.wustl.edu/news/jumping-genes-in-cancer-cells-open-door-to-new-immunotherapies/































