近日,FDA批准了首个遗传性肿瘤基因检测产品,为未来监管机构批准类似产品所需的预期性能和相关数据建立了标准,也为未来的基因检测市场带来了新的机遇。
2021年2月,Invitae公司与妙佑医疗国际(梅奥诊所,Mayo clinic)合作的一项研究发表在《JAMA Oncology》上,研究结果支持对所有肿瘤患者进行遗传基因检测,且当前标准指南遗漏了近一半的遗传变异患者。
2021年3月29日,Invitae公司向FDA递交De Novo上市申请(一般针对新型低至中风险设备的监管路径,且当前无法找到实质等同产品,并且其有效性可通过一般或特殊过程取得保证的产品)。
2023年9月29日,历时两年半,FDA通过De Novo审查程序批准了Invitae公司的 Invitae Common Hereditary Cancers Panel 产品上市(II类),用于识别与遗传性肿瘤相关的47个基因变异情况。2023年10月24日,FDA更新De Novo的Reclassification Order,并对该产品的批准进行了详细说明。同时,这也是FDA批准的首个遗传性肿瘤基因检测产品,为未来监管机构批准类似产品所需的预期性能和相关数据建立了标准(后续走FDA 510(k)申请路径)。

▲ FDA批准首个遗传性肿瘤基因检测产品
新近研究表明,遗传性肿瘤约占所有肿瘤的10%,这部分肿瘤具有家族遗传性。
遗传性肿瘤
遗传性肿瘤患者有以下共同特点:
(1)肿瘤是在相对年轻的年龄发展起来的。
(2)在病人身上可能会发展成多种癌症。
大多数导致遗传性肿瘤的基因有50%的机会或概率会遗传给下一代(无论什么性别)。根据最新NCCN指南的建议,遗传性肿瘤应进行相关的基因检测,以期筛查和预防肿瘤的发生。
遗传性肿瘤基因检测的好处,主要体现在三个方面:
(1)治疗选择:如果已经确诊肿瘤,遗传性肿瘤基因检测结果会指导医生使用更好的治疗方法,包括特定类型的手术、化疗或有针对性的治疗(PARPi等)。在某些情况下,还有参加临床试验的机会。
(2)未来健康:遗传性肿瘤基因检测结果可能会提示未来发展为某种肿瘤的可能性有多大,这时候可以积极主动地与临床医生进行沟通并考虑降低风险的手术或使用肿瘤化学预防药物,亦或是增加未来的筛查次数。
(3)家庭成员:如果肿瘤患者已经发现携带某种遗传性肿瘤基因突变,这意味着家庭成员也有罹患癌症的风险。这时候他们可以接受肿瘤基因检测,如果检测为阳性,可以更频繁地进行肿瘤筛查,以便在治疗最有效的时候及早干预。
FDA批准遗传性肿瘤产品
FDA批准的 Invitae Common Hereditary Cancers Panel 是一款针对常见遗传性肿瘤的IVD产品,重点关注47个已知基因,这些基因包含成千上万个增加罹患某种肿瘤风险的遗传变异。近年来发表的多项同行评议研究已经证明了它的临床实用性和效用性:确定肿瘤的潜在风险,为患者的管理和治疗提供信息,并帮助风险增加的人预防肿瘤的发生。
产品名称:Invitae Common Hereditary Cancers Panel
获批时间:2023年9月29日(De Novo)
预期用途:该产品是一款基于NGS的体外诊断试剂,用于检测从全血中提取的胚系人类基因组DNA,以分析47个基因的点突变、小插入缺失及拷贝数变异(这些基因中有一种致病性变异的个体发展为某些肿瘤的风险增加)。该检测产品旨在根据专业指南为合格的医疗保健专业人员提供信息,用于评估遗传性肿瘤的风险,并帮助识别与诊断肿瘤可能相关的遗传基因变异。该检测不可用于肿瘤筛查或产前检查。检测结果旨在附加实验结果、家族史和临床结果的背景下进行解释
检测平台:NGS平台
基因数量:47基因
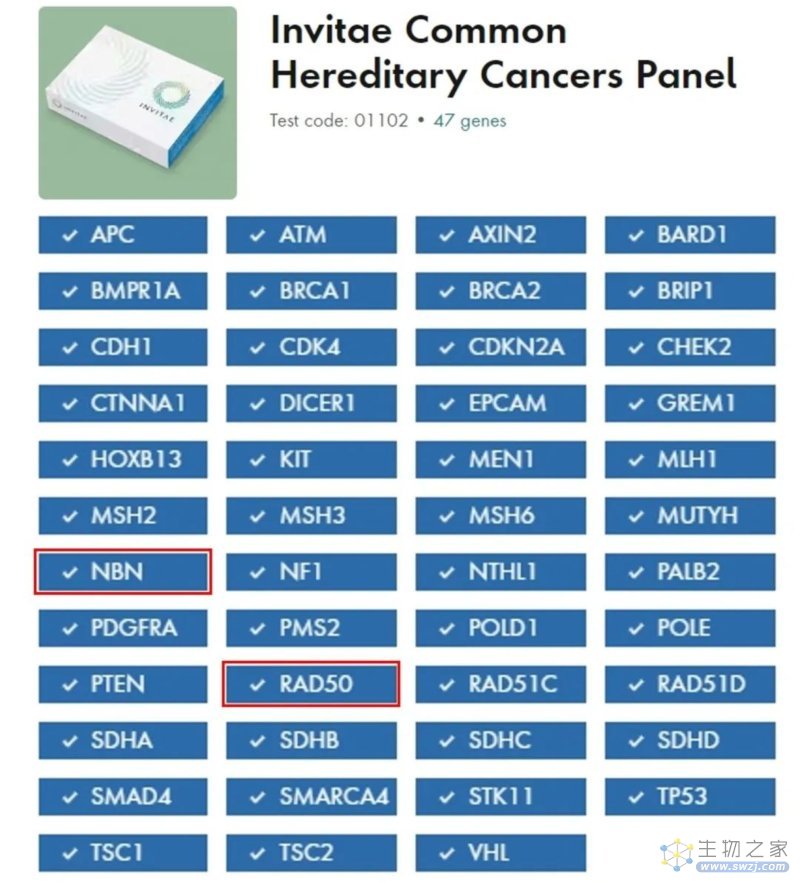
*注:NBN和RAD50基因的杂合致病性/可能致病性胚系变异与癌症风险增加没有明显关联;然而,这些变异可能使某些患者有资格进行针对同源重组缺陷(HRD)肿瘤的临床试验。该试验是专门为可遗传的胚系突变而设计的,不适用于检测肿瘤组织中的体细胞突变。
检测周期:10-21天(平均14天)
样本类型:3ml全血(EDTA管);次选唾液、口腔样本或gDNA
临床性能:该产品检测了9,000多个临床样本,所有检测的变异类型准确度达到了99.0%
临床注释:严格遵循ACMG准则,依照这些准则建议的证据框架,并根据同行审查文献和Invitae数据库中的证据,解释所检测的变异(致病的、可能致病的、意义未明的、可能良性的、良性的)
遗传性肿瘤类型:该产品主要针对遗传性乳腺癌、卵巢癌、子宫癌、前列腺癌、结直肠癌、胃癌、黑色素瘤和胰腺癌。(值得注意的是,该产品是针对常见遗传性肿瘤,并非Invitae的多癌遗传检测产品(84基因):可覆盖更多遗传性肿瘤,如肉瘤和血液肿瘤等5)
遗传性肿瘤综合征:该产品主要检测22种遗传性肿瘤综合征,具体为:

▲ Invitae常见遗传性肿瘤产品检测病症信息
详解信息:
(1)共济失调毛细血管扩张症(A-T):检测ATM基因,常隐遗传;
(2)结构性错配修复缺陷综合征(CMMR-D):检测MLH1、MSH2、MSH6和PMS2基因(双等位基因突变),常隐遗传;
(3)考登和考登样综合征:检测PTEN基因,常显遗传;
(4)DICER1综合症:检测DICER1基因,常显遗传;
(5)家族性腺瘤性息肉病:检测APC基因,常显遗传;
(6)家族性胃肠道间质瘤:检测KIT、PDGFRA、SDHB、SDHC基因,常显遗传;
(7)Fanconi贫血:检测FANCA、FANCD1(BRCA2)、FANCN(PALB2)等基因,常隐或X连锁隐性遗传;
(8)遗传性乳腺癌卵巢癌综合征(HBOC):检测BRCA1/2基因,常显遗传;
(9)遗传性弥漫性胃癌综合征(HGDC):检测CDH1基因,常显遗传;
(10)幼年性息肉病综合征(JPS):检测BMPR1A、SMAD4、ENG基因,常显遗传;
(11)Li-Fraumeni综合征(LFS):检测TP53基因,常显遗传;
(12)Lynch综合征(又称HNPCC):检测MLH1、MSH2、MSH6、MSH3、PMS1、PMS2、TACSTD1基因,常显遗传;
(13)黑色素瘤-胰腺癌综合征(M-PCS):检测CDKN2A基因,常显遗传;
(14)多发性内分泌腺瘤病1型(MEN1):检测MEN1基因,常显遗传;
(15)MUTYH相关息肉病:检测MUTYH基因,常隐遗传;
(16)神经纤维瘤病,1型(NF1):检测NF1基因,常显遗传;
(17)Nijmegen断裂综合征(NBS):检测NBN基因,常隐遗传;
(18)oligodontia-结直肠癌综合征:检测AXIN2基因,常显遗传;
(19)黑斑息肉综合症(PJS):检测STK11基因,常显遗传;
(20)横纹肌瘤易感综合征(RTPS):检测SMARCB1基因,常显遗传;
(21)结节性硬化症(TSC):检测TSC1/2基因,常显遗传;
(22)VonHippel-Lindau综合征(VHL):检测VHL基因,常显遗传。
*当我们详细拆解每种遗传性肿瘤的相关基因后发现,官网宣传能检测的22种遗传性肿瘤综合征似乎与47基因panel有所出入。这也就意味着47基因panel的遗传性肿瘤产品只是针对常见的部分遗传性肿瘤。遗传性肿瘤panel的设计可能更大,大到80多个基因。
遗传性肿瘤vs肿瘤易感
遗传性肿瘤基因检测和肿瘤易感基因检测原本是同一个意思,但随着市场的商业化,慢慢衍生出两个分支,即偏向临床级应用的遗传性肿瘤基因检测和偏向于消费级的肿瘤易感基因检测。两者区别较大。
遗传性肿瘤基因检测,根据相关临床指南推荐进行遗传性肿瘤的基因测序,并结合相关的遗传数据库对检测结果进行分类解读,其检测结果具有明确的临床预期用途。当前针对肿瘤患者的用药基因检测产品中,通常会包含遗传性肿瘤的基因检测部分(NGS中大panel),如果检测为阳性,一方面可以指导临床治疗,另一方面则建议对相关直系亲属进行遗传性肿瘤的基因检测,并进行遗传咨询。
遗传性肿瘤基因检测是抑癌基因、错配修复基因或癌基因,这些基因突变的特点是“频率低但致病性高”,即这些基因突变在总人群中携带概率很低,通常不到1%(SNV),若一旦携带有这种突变,则得病的概率非常高,可能在80%以上。【检测技术主要为NGS,偶尔会进行Sanger验证,价格在数千元不等】
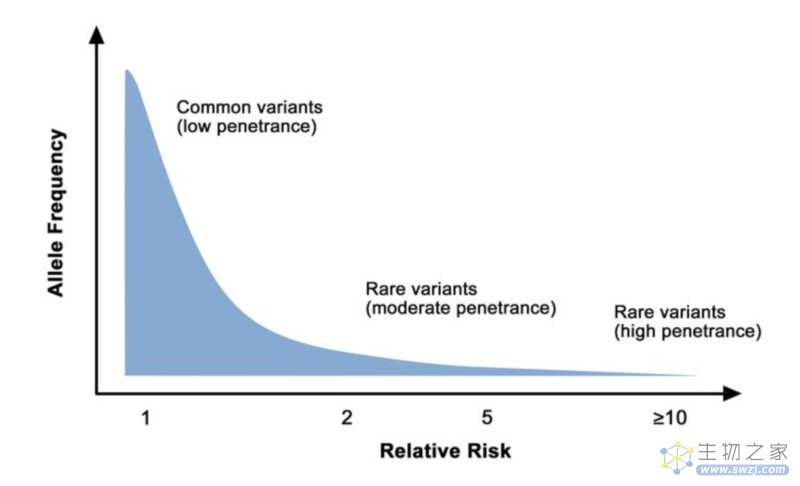
▲ 癌症风险的基因结构
基因组关联分析(GWAS)或文献资料查找相应肿瘤易感基因的SNP位点(rs号),然后找到他们的OR值(或HR值)和基因型频率,最后通过相关的遗传风险模型来做综合风险的评估或做一个疾病的正态分布模型,划分高/中/低风险。
肿瘤易感基因检测,通常检测的是易感基因的某些SNP位点,其特点是“频率高但致病性低”,即这些位点在人群中频率往往可达到5%~50%(SNP),但通常不直接致病,而是增加部分的风险。【检测技术主要为qPCR或MassARRAY等,价格在数十元至数百元不等】
综合而言,肿瘤是一种基因病,遗传因素在罹患肿瘤的风险中起着关键作用,遗传性肿瘤基因检测对于肿瘤的治疗决策、风险筛查和干预具有重要的指导意义。随着FDA批准了首个遗传性肿瘤基因检测产品,为未来的基因检测市场发展带来了新的机遇。
参考资料:
1.Samadder NJ, et al. Comparison of Universal Genetic Testing vs Guideline-Directed Targeted Testing for Patients With Hereditary Cancer Syndrome. JAMA Oncol. 2021 Feb 1;7(2):230-237.
2.https://www.fda.gov/news-events/press-announcements/fda-grants-first-marketing-authorization-dna-test-assess-predisposition-dozens-cancer-types
3.https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/denovo.cfm?id=DEN210011
4.Garutti M,et al. Hereditary Cancer Syndromes: A Comprehensive Review with a Visual Tool. Genes (Basel). 2023 Apr 30;14(5):1025.
5.https://www.invitae.com/en/providers/test-catalog/test-01101
6.https://www.invitae.com/en/providers/test-catalog/test-01102































