免疫疗法占据了抗癌领域举足轻重的地位,一些抗体和抗体片段已被开发用于治疗癌症,解决了在治疗中选择性细胞靶向的问题,但仍存在一些不足限制了其临床应用,比如:全长抗体由于体积大无法扩散到实体肿瘤的深处;作为替代的小抗体片段在体内停留时间较短,与靶标分离率高;抗体与健康细胞上的受体抗原结合还会产生不可忽视的副作用……
如何实现癌症的精准治疗?近日,英国东英吉利大学的Amit Sachdeva教授团队在Nature Chemical Biology上发表最新研究成果,作者通过位点特异性编码设计光活性和光反应性的抗体片段,利用光控制实现与EGFR靶标的共价结合,有望优于目前最先进的癌症免疫疗法。

图片来源:doi: 10.1038/s41589-022-01251-9.
这篇研究中用到了两个功能元件,“光笼”功能基团,它可以在无光的情况下抑制抗体-抗原结合,并在光照射下恢复结合。“光反应性氨基酸”可以在光照下促进与靶标形成共价键但不抑制结合。也就是说,通过在抗体的特定位置安装“光笼”功能基团和光反应性氨基酸,即可实现在肿瘤部位的光响应,从而减少基于抗体疗法的副作用,进一步实现抗体的高度靶向。研究人员表示,共价键的作用就像将两块塑料熔合在一起。这样一来,药物分子可以永久固定在肿瘤上。
这样巧妙的设计如何实现呢?
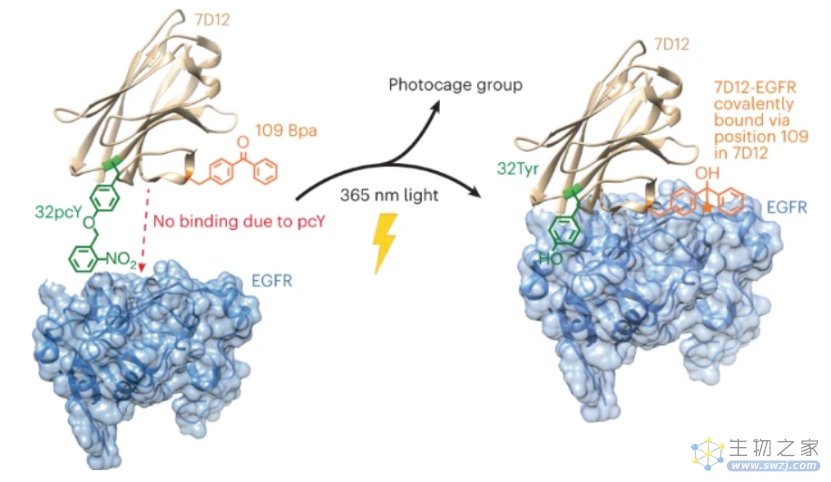
图1. 光活性和光反应性抗体与EGFR结合示意图。图片来源:doi: 10.1038/s41589-022-01251-9.
1 构建高亲和光反应性7D12突变体
在多种实体肿瘤组织中存在表皮生长因子受体(EGFR)的高表达,7D12是一种抗体片段,能够特异性的与EGFR蛋白结合,是治疗EGFR阳性癌症的候选药物。p-苯甲酰基-l-苯丙氨酸(Bpa)是一种光反应性氨基酸,可以在365 nm紫外光下发生光交联,也就是说Bpa能够与受体形成共价键,将其引入到抗体中可以解决抗体片段停留时间短的问题。
首先,研究人员需要在7D12中找到一个可以容纳Bpa的位点,使其不会干扰与EGFR的结合。通过将Bpa引入到7D12的酪氨酸32,109和113这三个位点中,分别观察7D12突变体与癌细胞表面EGFR的结合情况,发现当引入Bpa到7D12中的109位时效果最好,基本不会干扰7D12突变抗体(7D12-109Bpa)与EGFR的结合。
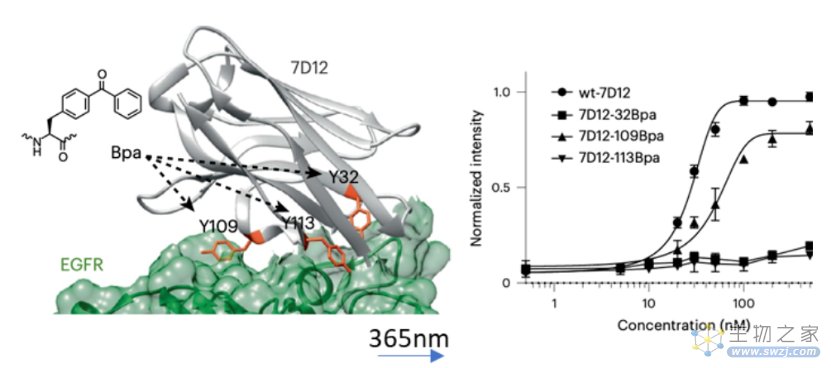
图2. Bpa在单链抗体片段7D12中的位点特异性结合。图片来源:doi: 10.1038/s41589-022-01251-9.
那么,7D12-109Bpa是否能如预想般地在365 nm紫外光下与EGFR形成共价键也需要确认。将7D12-109Bpa与EGFR的胞外结构域(sEGFR)孵育,然后用365 nm光照射和凝胶电泳分析,验证了7D12与EGFR之间光依赖的共价键的形成需要109位Bpa的存在,因为在无Bpa的野生型7D12与EGFR之间没有观察到共价键的形成。
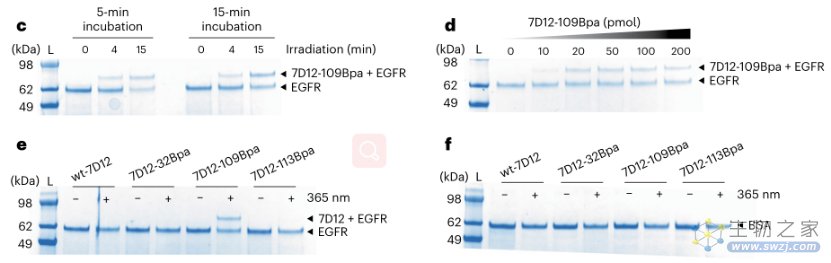
图3. 高亲和光反应性7D12突变体的开发验证。图片来源:doi: 10.1038/s41589-022-01251-9.
2 构建光活性和光反应性7D12突变体
先前有研究表明,当“光笼”酪氨酸(pcY) 存在于7D12中的32位时,7D12与EGFR将无法结合,而经365 nm光照可以恢复。在此基础上,研究人员希望构建同时含有32位pcY和109位Bpa的7D12突变体,这样即可赋予7D12光活性和光反应性。然而,将两个氨基酸同时插入到7D12抗体片段的特异性位点中并不是一件容易的事,研究人员经过多番尝试,最终开发出一种高选择性的MbPyl(Bpa)RS/tRNA,它能够准确地将pcY和Bpa插入到7D12抗体的32和109位。
具体来说,研究人员构建了pSANG-oR-o7D12-Dual-Pyl(Bpa)和pULTRA-pcY两种质粒,使其共转化至BL21细胞中,实现pcY在7D12的32位和Bpa在109位的双特异性结合,形成7D12-32pcY-109Bpa突变体。这种突变体与EGFR的结合是否会随着365 nm光照而改变呢?研究发现,正常情况下突变体中32位的pcY抑制了7D12-EGFR的结合,但在365 nm光照十分钟后,结合恢复,而且照射后7D12-32pcY-109Bpa与EGFR的结合亲和力约为103 nM,因此可以说明7D12-32pcY-109Bpa是一种有效的光活性-光反应性抗体片段。
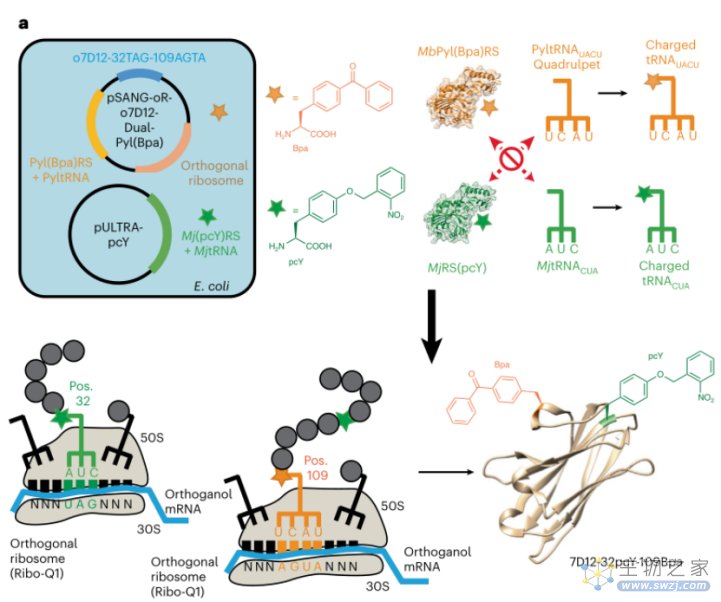
图4. pcY和Bpa在7D12中位点特异性双掺入示意图。图片来源:doi: 10.1038/s41589-022-01251-9.
简而言之,作者开发了一种光活性-光反应性7D12-32pcY-109Bpa突变抗体片段,这种抗体片段和EGFR的共价结合受到光调控,可以解决普通抗体的毒性和停留时间短的问题。
这样来看,通过照射激活抗体就能攻击肿瘤细胞。对于皮肤癌,要么直接照射到皮肤上,要么使用可植入体内肿瘤部位的像小LED灯那样的发光物质,从而对特定的癌细胞进行治疗,这将使癌症治疗更加有效和有针对性,因为只有肿瘤附近的分子会被激活,而不会影响其他细胞。还会减少副作用,延长抗体在体内的停留时间,甚至优于目前最先进的癌症免疫疗法。研究者们希望在5—10年内看到下一代光激活免疫疗法被用于治疗癌症。
参考文献:
Bridge T, Wegmann U, Crack JC, Orman K, Shaikh SA, Farndon W, Martins C, Saalbach G, Sachdeva A. Site-specific encoding of photoactivity and photoreactivity into antibody fragments. Nat Chem Biol. 2023 Feb 16. doi: 10.1038/s41589-022-01251-9.































