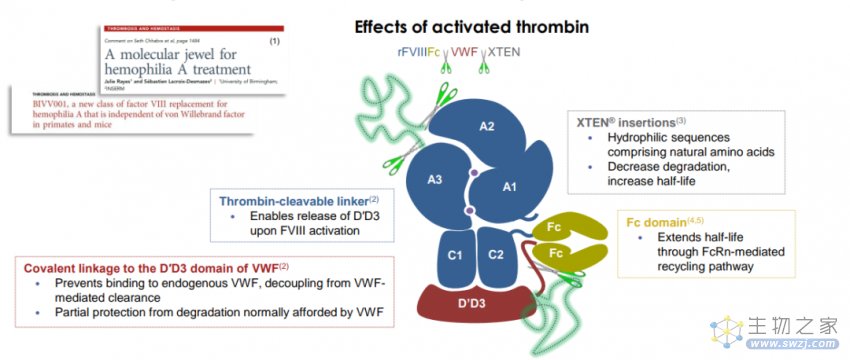
2月23日,赛诺菲宣布,FDA已批准A型血友病治疗药物efanesoctocog alfa的生物制品许可申请(BLA),这是一种first-in-class高持续性的凝血因子VIII替代疗法。FDA曾授予Efanesoctocog alfa突破性疗法认定、快速通道资格以及孤儿药资格。

Efanesoctocog alfa(商品名:ALTUVIIIO)是一款新型的凝血因子VIII疗法,通过将凝血因子VIII与Fc、血管性血友病因子(vWF)部分区域和XTEN多肽片段融合在一起,克服vWF对FVIII半衰期延长限制,显著延长药品在血液循环内的时间。该疗法旨在通过每周1次的预防性给药,维持正常的FVIII活性水平以延长对A型血友病患者的出血保护。
此次上市申请是基于一项开放标签、多中心的III期研究(XTEND-1)数据。该研究纳入了159例12岁及以上患者,旨在评估每周1次接受efanesoctocog alfa对既往接受过凝血因子VIII(FVIII)替代疗法的严重A型血友病患者的安全性、有效性和药代动力学特征。
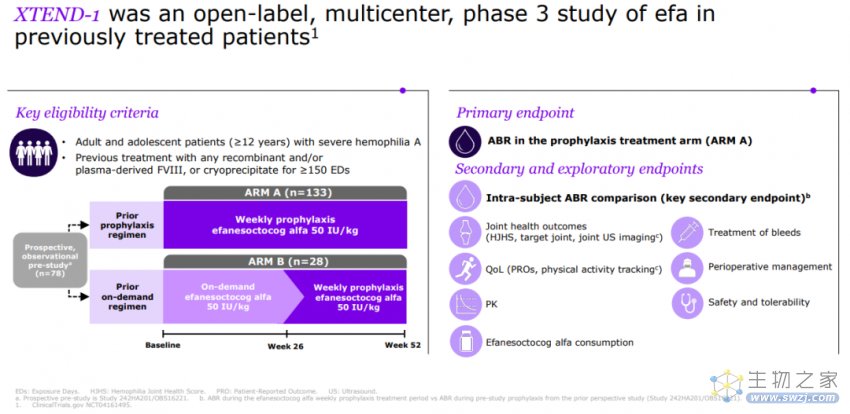
XTEND-1设计方案
XTEND-1设有两个平行组:A组即预防组(n=133)的成员每周给予50 IU/kg Efanesoctocog alfa,持续 52 周;B组即按需组(n=26)的成员最初根据需要给予50 IU/kg,持续 26 周,之后变成每周一次给药,持续 26 周。
该研究的主要终点是A组的年出血率(ABR)。结果显示,在每周接受一次efanesoctocog alfa预防性治疗的A组患者中,52周内中位年出血率(ABR)为0,平均ABR为0.70,达到了具有临床意义的出血预防的主要终点。
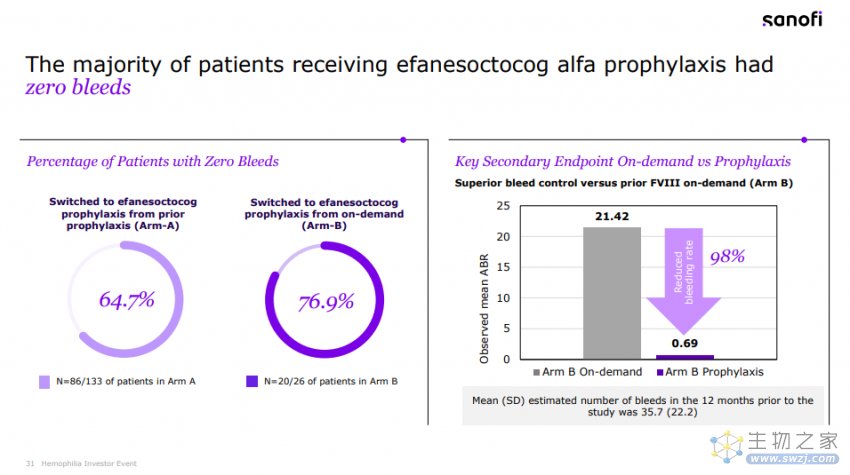
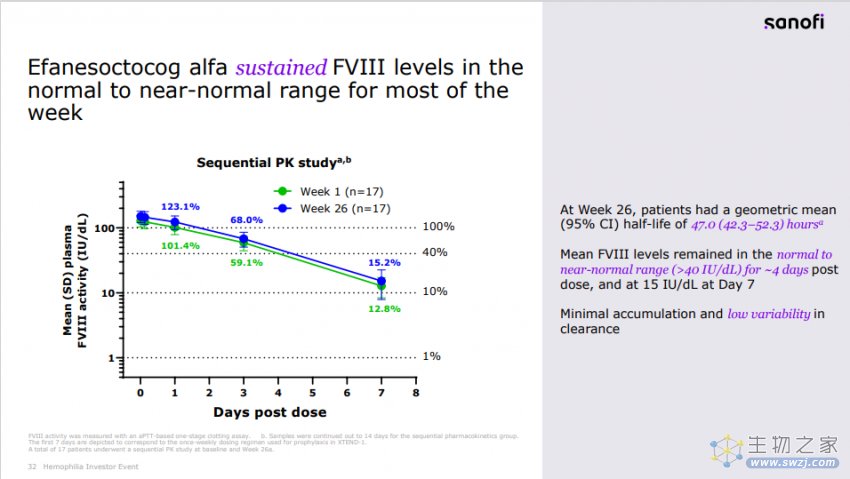
相较于先前预防性FVIII替代治疗,efanesoctocog alfa在预防出血事件方面表现出优效性。在一周的大部分时间里,efanesoctocog alfa可以维持FVIII水平在正常至接近正常范围内。
此外,XTEND-Kids的中期数据显示,12岁以下的儿童每周接受一次efanesoctocog alfa,持续26周(n=23),平均ABR为0.5,中位ABR为0。
赛诺菲首席执行官Paul Hudson表示:“今天Efanesoctocog alfa的获批使患者和医生能够重新定义血友病患者的生活。通过每周一次的剂量,Efanesoctocog alfa可持续性实现的凝血因子活性水平,有望改变血友病患者的出血状况。”































