癌症可以被认为是一种由可溶性因子释放所介导的全身性疾病。实际上,癌症会改变多个器官的功能,包括那些未被转移的器官。例如,肿瘤来源的细胞外囊泡与颗粒(Extracellular Vesicles and Particles,EVP)能够在多个未被转移器官中建立转移前微环境(Premetastatic Niche,PMN),并重新编程细胞功能。
在癌症进展过程中,没有发生癌症转移的肝脏功能的重编程尚未得到广泛研究。然而,肝脏已被确定为肿瘤来源的EVP的主要靶器官之一,那么,EVP能会如何影响和改变肝脏的功能呢?
2023年5月24日,威尔康奈尔医学院 David Lyden 教授实验室(王刚博士、李建龙博士为第一作者)在 Nature 期刊发表了题为:Tumour extracellular vesicles and particles dysregulate liver metabolism 的研究论文。
该研究表明,肿瘤细胞在没有发生肝转移时,其也能够通过分泌细胞外囊泡与颗粒(EVP)诱导肝脏代谢功能失调。该研究还揭示了靶向EVP和肿瘤坏死因子(TNF),可以防止癌症患者的脂肪肝形成并提高化疗效果。

在这项研究中,研究团队通过对多种小鼠肿瘤模型和来自癌症患者的肝脏组织进行多组学分析,证明了肿瘤来源的细胞外囊泡与颗粒(EVP)中的饱和脂肪酸诱导代谢失调,从而促进脂肪肝的形成,并降低肝脏的药物代谢能力。
该研究表明,炎症、脂肪肝和代谢失调是小鼠模型和肝外转移患者全身性肝脏病变的标志。研究团队发现,肿瘤来源的EVP是癌症诱导的肝脏重编程的关键介质,而敲除Rab27a可以减少肿瘤分泌EVP,从而逆转这一过程。
David Lyden 团队在此前的研究中将EVP分为三个亚型,分别是大外泌体(large exosomes)、小外泌体(small exosomes)和外泌颗粒(exomeres),该研究显示,这几种EVP亚型都能够导致肝脏功能失调。
肿瘤EVP中携带的的脂肪酸货物,特别是棕榈酸,能够诱导Kupffer细胞分泌肿瘤坏死因子(TNF),产生促炎微环境,抑制脂肪酸代谢和氧化磷酸化,促进脂肪肝的形成。值得注意的是,清除Kupffer细胞或通过单克隆抗体阻断TNF,可显著减少肿瘤诱导的脂肪肝的产生。肿瘤植入或肿瘤EVP预处理,以TNF依赖的方式降低细胞色素P450基因表达并减弱药物代谢。
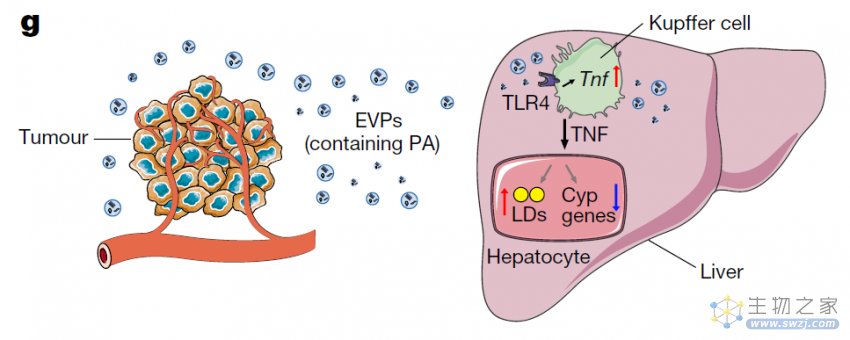
EVP介导的肝脏代谢失调的示意图:肿瘤源性EVP特异性靶向肝脏中的Kupffer细胞,EVP中的饱和脂肪酸,例如棕榈酸(PA),以TLR4依赖的方式刺激Kupffer细胞分泌肿瘤坏死因子(TNF),这在肝脏中产生促炎微环境,从而系统性地诱导脂肪肝形成并抑制肝脏的药物代谢活性。
研究团队还在未发生肝脏转移的胰腺癌患者的肝脏中观察到了脂肪肝和细胞色素P450的表达降低,而这些患者在后来发生了肝外转移,突出了这项研究结果的临床相关性。
值得注意的是,肿瘤EVP增强了化疗的副作用,包括骨髓抑制和心脏毒性,这表明肿瘤源性EVP对肝脏的代谢重编程可能会限制癌症患者的化疗耐受性。
总的来说,这些研究结果揭示了肿瘤源性EVP如何导致肝脏代谢功能的失调,及其靶向潜力,与TNF抑制一起,可以防止癌症患者的脂肪肝形成并提高化疗效果。
论文链接:https://www.nature.com/articles/s41586-023-06114-4































